Em Química, Termoquímica é a parte da Termodinâmica responsável pelo estudo quantitativo das trocas de calor desenvolvidas durante uma reação química entre o sistema e o meio ambiente.
Publicidade
Conceitos fundamentais
Antes de iniciarmos os estudos sobre as quantidades de calor liberados ou absorvidos durante uma reação química, é necessário relembrarmos alguns conceitos fundamentais da Termodinâmica.
- Calor: denomina-se calor a energia térmica em trânsito, sendo um conceito que se relaciona com a diferença de temperatura entre dois sistemas. O calor sempre flui do objeto de mais alta temperatura (mais quente) para o de mais baixa temperatura (mais frio).
- Energia: denomina-se energia a capacidade de realizar trabalho ou transformar calor.
- Trabalho: quando uma força é aplicada em um objeto para deslocá-lo de um ponto a outro, diz-se que foi realizado trabalho sobre o objeto.Trata-se da troca de energia sem influência de diferenças de temperatura.
As transformações termoquímicas
São dois os tipos de reações em que há troca de energia na forma de calor: as reações exotérmicas e as endotérmicas.
Reações exotérmicas
Caracterizam-se pela liberação de energia para o meio ambiente. Alguns exemplos deste tipo de reação são a queima do gás de cozinha, a condensação da água e a queima de velas.
Reações endotérmicas
São aquelas nas quais um sistema reativo absorve calor do meio ambiente. Alguns exemplos deste tipo de reação são a fotossíntese, o cozimento de alimentos e a bolsa de gelo instantânea.
Entalpia (ΔH)
Segundo a termodinâmica clássica, a entalpia é a grandeza que mede a energia total de um sistema capaz de ser removida na forma de calor. Como vimos, nos dois tipos de reações descritos há troca de calor entre o sistema reativo e o meio ambiente. Este fluxo de calor é chamado de entalpia.
A entalpia (representada pela letra H) de um sistema está relacionada com a sua energia interna. Na prática, não pode ser determinada, no entanto, é possível medir a variação de entalpia (ΔH) de um processo por meio de aparelhos denominados calorímetros.
Publicidade
Variação de entalpia (ΔH)
A variação de entalpia corresponde ao calor liberado ou absorvido a pressão constante.
Pode ser calculada pela seguinte equação:
ΔH = Hf – Hi
Publicidade
Onde Hf e Hi representam, respectivamente, a entalpia no estado final (produtos) e a entalpia no estado inicial (reagentes).
1) Reação endotérmica: A reação entalpia do sistema aumenta. Neste caso, ΔH > 0.
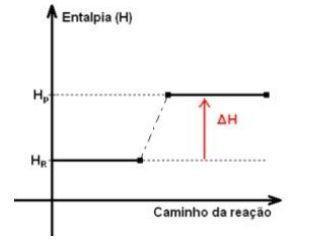
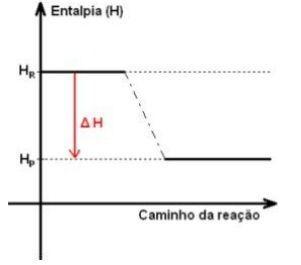
2) Reação exotérmica: A reação entalpia do sistema diminui. Neste caso, ΔH < 0.
Tipos de variação de entalpia
1) Entalpia padrão de combustão
Quantidade de energia envolvida na queima de 1 mol de uma determinada substância na presença de gás oxigênio. Neste caso, todas as substâncias estão no estado padrão.
Exemplos:
CH4 + O2 → CO2 + H2O
S + O2 → SO2
C2H6O + 2 O2→ CO + 2 H2O
2) Entalpia padrão de formação
Quantidade de energia liberada ou absorvida quando 1 mol de substância simples reage e o produto final é uma única substância composta.
Exemplos:
1/2H2 (g) + 1/2Cl2 (g) → HCl(g)
H2 + 2 O2 + S→ H2SO4
Referências
Termoquímica. Disponível em: http://www.ufjf.br/cursinho/
Termodinâmica e Termoquímica. Disponível em: http://ensinoadistancia.pro.br/

Por Débora Silva
Formada em Letras (Licenciatura em Língua Portuguesa e suas Literaturas) pela Universidade Federal de São João del-Rei (UFSJ), com certificado DELE (Diploma de Español como Lengua Extranjera. Produz conteúdo web, abrangendo diversos temas, e realiza trabalhos de tradução e versão em Português-Espanhol.
Silva, Débora. Termoquímica. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/termoquimica. Acesso em: 31 de December de 2025.
1. [UNIUBE MG/2013] O etanol é um composto orgânico cuja ebulição ocorre a uma temperatura de 78,4 ºC. Pode ser obtido a partir de vários métodos. No Brasil, é produzido através da fermentação da cana-de-açúcar, já que a sua disponibilidade agrícola é bastante ampla no nosso País. A reação química da combustão completa do etanol e o seu valor da entalpia são dados a seguir:
C2H5OH(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) + 327 kcal/mol
Sabendo-se que a entalpia é uma propriedade extensiva, na queima de 115 g desse combustível, a quantidade de calor envolvida na reação é de, aproximadamente:
a)-327 kcal.
b)+817,5 kcal
c)+327 kcal
d)-817,5 kcal
e)-130,8 kcal
2. [OSEC] Analise as afirmativas abaixo:
I. Entalpia (H) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta D H positivo.
III. O calor de reação de um processo químico será dado por D H.
a) somente I é correta
b) somente II é correta
c) somente III é correta
d) as afirmativas I e II são corretas
e) as afirmativas I e III são corretas.
1. [D]
2. [E]