Em 1869, o químico Dimitri Mendeleiev foi o primeiro a organizar os elementos químicos em forma de uma tabela, respeitando uma variável periódica. Mendeleiev percebeu que, ao distribuir os 60 elementos conhecidos em função de suas massas de seus átomos, era possível observar certa periodicidade na repetição de determinadas propriedades destes elementos.
Publicidade

Essa forma de arranjo determinou a formação de colunas (grupos) que continham elementos de propriedades químicas parecidas. Na tabela de Mendeleiev, alguns espaços ainda estavam em branco. O químico concluiu que, seguindo o princípio da periodicidade da distribuição, esses espaços vagos pertenciam a elementos ainda então desconhecidos. Dessa forma, Mendeleiev pode não apenas confirmar a existência de novos elementos que ainda seriam descobertos, mas também prever com precisão suas propriedades, observando quais os locais da tabela que seriam ocupados.
Moseley determinou que a lei periódica da tabela deveria seguir em função do número atômico, reorganizando a tabela periódica na forma como é usada atualmente.
“Quando os elementos químicos são agrupados em ordem crescente de número atômico (Z), observa-se a repetição periódica de várias de suas propriedades”. (Cruz e Barbosa, 2008, pg. 3)
A última grande modificação realizada na tabela periódica foi na década de 1950. Com a descoberta do plutônio, durante o projeto Manhattan, o químico Gleen Seaborg descobriu e isolou, além do próprio plutônio, outros nove elementos químicos transurânicos: amerício, cúrio, berquélio, califórnio, einstênio, férmio, mendelévio, nobélio e seabórgio. E em 1951, ele ganhou o Prêmio Nobel de Química por suas descobertas.
Classificação dos elementos
Os elementos químicos estão classificados em metais, não-metais e gases nobres.
Publicidade
Metais: elementos que são bons condutores de calor e eletricidade. São sólidos nas CNTP (com exceção do mercúrio).
Não metais: elementos que são maus condutores de corrente elétrica e calor. Assumem qualquer estado físico na temperatura ambiente.
Gases nobres: elementos de baixa reatividade.
Os elementos ainda são classificados também em representativos (distribuição eletrônica termina em s ou p) ou de transição (transição intena: distribuição acaba em d; transição externa: acaba em f).
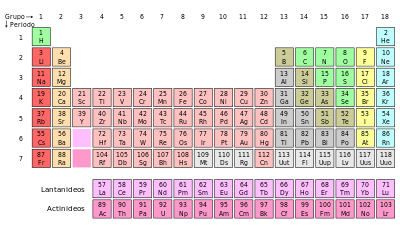
Os elementos são localizados na tabela periódica através de seu grupo e de seu período.
Publicidade
Cada linha (horizontal) da tabela periódica representa um período.
Períodos são em número de sete, e indicam o número de níveis que o elemento possui, ou seja, o número de camadas eletrônicas da distribuição de elétrons.
Já os grupos são colunas (vertical) que apresentam elementos químicos que compartilham propriedades.
A seguir estão listados os grupos encontrados na tabela periódica:
Grupo 1: Metais alcalinos
Grupo 2: Metais alcalino-terrosos
Grupo 16 (ou 6A): Calcogênios
Grupo 17 (ou 7A): Halogênios
Grupo 18 (ou 8A): Gases nobres
Você sabia?
Após a confirmação da União Internacional de Química Pura e Aplicada, agora quatro novos elementos sintéticos fazem parte da tabela periódica. São eles: unúntrio (Uut, ou elemento 113), unumpêntio (Uup, ou elemento 115), ununséptio (Uus, ou elemento 117) e ununóctio (Uuo, ou elemento 118). São altamente radioativos e instáveis, características que dificultam muito seu estudo.
Referências
http://www.bbc.com/portuguese/noticias/2016/01/160104_novos_elementos_tabela_periodica_rb
CRUZ, E. C. P.; BARBOSA, F. Química. Curitiba: IESDE Brasil S. A., 2008. Disponível em: <http://www.agracadaquimica.com.br/quimica/arealegal/outros/275.pdf>. Acesso em 30 de maio de 2016.

Por Carlos Ferreira
Formado em Ciências Econômicas e Jornalismo. Possui ampla experiência editorial e redacional em conteúdos jornalísticos com foco em mídias digitais.
Ferreira, Carlos. Tabela Periódica. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/tabela-periodica. Acesso em: 01 de April de 2025.
1. (UFAL – UFRN) Se fosse preparado um gás nobre artificial, que na tabela periódica se localizasse logo do Rn (Z = 86), seu número atômico seria:
a)140
b)87
c)223
d)174
e)118
2. (FUVEST) Na tabela periódica, os elementos químicos estão ordenados:
a)Rigorosamente segundo suas massas atômicas crescentes e, salvo algumas exceções, também segundo seus raios atômicos crescentes
b)De maneira tal que os ocupantes de uma mesma família têm o mesmo número de níveis de energia
c)De tal modo que todos os elementos de transição se localizam no mesmo período
d)Segundo seus volumes atômicos crescentes e pontos de fusão decrescentes
e)De maneira tal que o volume atômico, ponto de fusão e energia de ionização variam periodicamente
1. [e]
2. [e]