Número de oxidação é um indicador do quanto um átomo perde ou ganha elétrons numa reação química com intuito de adquirir estabilidade eletrônica. A regra geral é dada pelo fato de átomos que perdem elétrons tem seu número de oxidação, o Nox, aumentado enquanto átomos que ganham elétrons tem seu Nox diminuído. Conceitualmente, um elemento pode adquirir Nox positivo, negativo ou igual a zero, e sempre numa molécula, o Nox total dos componentes resultam numa soma igual a zero.
Publicidade
Podemos dizer também que o Nox é a carga assumida por um átomo quando a ligação química é quebrada.
Em determinada molécula, há combinação de átomos com propriedades diferentes, assim há átomos que possuem maior ou menos eletronegatividade, isto é, “atraem” elétrons com mais facilidade ou menos, respectivamente, adquirindo assim diversos estados de oxidação, dependendo do composto que é formado.
Compostos iônicos são formados por atrações eletrostáticas (ligação iônica), íons de cargas negativas que se atraem com íons de cargas positivas, formando assim um elemento neutro, neste caso, o Nox dos íons é correspondente às suas respectivas cargas. Por outro lado, compostos moleculares são formados por ligações covalentes, na qual há o compartilhamento de elétrons por elementos que tendem a doar e outros elementos que tendem a receber tais elétrons compartilhados, possibilitando assim uma carga elétrica parcial.
1. Determinação do número de oxidação em moléculas
Íons simples
Em íons simples, seu Nox equivale à sua carga elétrica. Exemplos:
- NaCl, temos que o Na+ possui carga +1, portanto seu Nox = +1; enquanto Cl– possui carga -1, tendo Nox = -1.
- CaF2, neste caso Ca+2 possui carga +2, tendo Nox = +2; e F– possui carga -1, logo, seu Nox = -1.
Elemento ou substância simples
Em substâncias simples – compostas por átomos do mesmo elemento – o Nox terá valor zero. Exemplos:
- O2, H2, N2, P4, S8, dentre outras.
Nox fixo em alguns casos
| Número de Oxidação | |
|---|---|
| Metais Alcalinos (Família 1A) | +1 |
| Metais Alcalinos-Terrosos (Família 2A) | +2 |
| Halogênios (Família 7A) | -1 |
| Calcogênios (Família 6 A) | -2 |
| Prata (Ag) | +1 |
| Zinco (Zn) | +2 |
| Alumínio (Al) | +3 |
| Hidreto metálico (Ex: NaH) | -1 |
| Oxigênio em Peróxidos (Ex H2O2) | -1 |
| Oxigênio em Superóxidos (Ex: NaO2) | -1/2 |
| Oxigênio em fluoretos (Ex: O2F2) | +1 |
| Oxigênio em fluoretos (Ex: OF2) | +2 |
Compostos moleculares
Em compostos moleculares a determinação do número de oxidação é simples e tem como condição obrigatória o resultado ser zero na soma dos Nox de todos os elementos da molécula. Aplica-se o cálculo de Nox em compostos moleculares quando há átomos cujo seu Nox seja desconhecido. Exemplo:
Publicidade
- Molécula de K2Cr2O7, pela fórmula molecular temos 2 átomos de potássio, 2 átomos de cromo e 7 átomos de oxigênio, também sabemos que o Nox do potássio por ser da família 1A é fixo em +1 e o Nox do oxigênio por ser da família 6A é -2, portanto, podemos transformar a molécula acima numa equação igualando a zero:
- 2(+1) + 2x + 7(-2) = 0, onde x representa o Nox do cromo, que é desconhecido
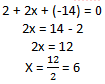
Portanto, o Nox do cromo, Cr, é +6.
Publicidade
Referências
ATKINS, P. W., JONES, L., Princípios de química: questionando a vida moderna e o meio ambiente. 3ed. Porto Alegre: Bookman, 2006.
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Número de oxidação. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/numero-de-oxidacao. Acesso em: 02 de April de 2025.
1. [UNEMAT/2011]
2O2 + NH4+→NO3– + 2H+ + H2O
É correto afirmar que o nitrogênio presente no ânion nitrato apresenta um número de oxidação (Nox) de:
a) -1
b) +3
c) +5
d) 0
e) -3
2. [UNEMAT/2011] O Número de Oxidação (Nox) pode ser definido como o número que mede a carga real ou a carga aparente de uma espécie química, sendo que um mesmo elemento químico pode assumir valores distintos de Nox, dependendo da substância em que esteja presente. Nesse sentido, o íon nitrato (NO–3) em alguns vegetais pode se transformar em gás nitrogênio (N2), alterando o valor do Nox do átomo de nitrogênio.
Neste processo de transformação, a variação do Nox do átomo de nitrogênio será de:
a) +2 para -2
b) +6 para 0
c) -5 para -2
d) +5 para 0
e) +3 para 0
1. [C]
O íon nitrato, NO3–, é um composto molecular com carga igual a -1. Para encontrar o Nox do nitrogênio, devemos armar uma conta com a seguinte fórmula:
x.3(-2) = -1
A fórmula acima se justifica, pois sabemos que o oxigênio tem Nox igual a -2, como na molécula há 3 átomos de oxigênio, multiplica-se por 3 o Nox do átomo em questão. Iguala-se tudo a -1 porque é a carga total do ânion nitrato. Desenvolvendo a conta temos:
x.(-6) = -1
x = 1 + 6
x = 5
Portanto, o Nox do nitrogênio no íon nitrato é +5.
2. [D]
Sabemos que o nitrogênio do íon nitrato possui Nox de +5. No enunciado diz que em determinados vegetais há a transformação de íon nitrato para gás nitrogênio, N2. Em compostos bimoleculares, o Nox dos átomos que o constituem é igual a 0, em todos os casos.