Número de massa é uma representação utilizada na atomística para designar a quantidade total de prótons e nêutrons no núcleo atômico. Se encontra na tabela periódica e, muitas vezes, é confundido com o número atômico ou com a massa atômica. Portanto, aprenda sobre o assunto e entenda a diferença das duas grandezas.
Publicidade
O que é o número de massa
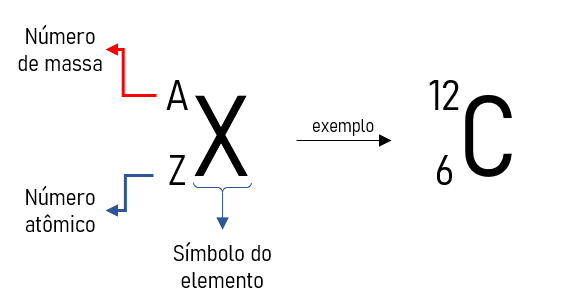
Representado pela letra maiúscula A, o número de massa se refere à massa de um átomo, aproximadamente. Segundo o teórico Ernest Rutherford, a massa de um elemento químico se concentra no núcleo atômico. Isso se dá pelo fato de os elétrons serem cerca de 1800 vezes mais leves que os prótons e nêutrons, ou seja, possuem uma massa desprezível. Como o núcleo é composto de prótons (cargas positivas) e nêutrons (cargas nulas), o valor de A é correspondente à soma dessas duas unidades.
Relacionadas
A maneira correta de representar o valor da massa de um elemento químico X, é do lado superior esquerdo do símbolo desse elemento, ou seja, AX. Existem casos em que o número atômico (Z) também está representado, porém, esse se localiza do lado inferior esquerdo do elemento, veja abaixo o exemplo de como representar corretamento o carbono-12, em outras palavras, o carbono que possui 6 prótons e 6 nêutrons.
Como calcular o número de massa
Para calcular esse valor de um átomo, é preciso conhecer a quantidade de prótons e nêutrons que ele possui no núcleo, visto que A representa a soma desses dois termos. Dessa forma, é possível encontrar o valor de A pela equação:
A = p + n
Em que:
Publicidade
- A: é o número de massa;
- p: indica o número de prótons (cargas positivas) no núcleo atômico;
- n: representa o número de nêutrons no núcleo.
Realizando modificações matemáticas nela, como rearranjar a ordem dos termos, é possível realizar o cálculo de qualquer uma das três grandezas correspondentes na equação. Veja abaixo alguns exemplos de como calcular o número de massa de determinado elemento químico.
Exemplo 1
Sabendo que o potássio (19K) possui 20 nêutrons que estabilizam o núcleo, qual é o valor de seu número de massa?
O número 19 ao lado do símbolo do elemento representa seu número atômico (Z). Como Z é igual ao número de prótons (Z = p), o cálculo de A é dado por:
Publicidade
A = p + n
A = 19 + 20
A = 39
Exemplo 2
Qual é o número de massa de um átomo que apresenta um número atômico igual a 60 e que possui no interior do seu núcleo 88 nêutrons?
Os valores fornecidos são os de Z = 60 e de n = 88. Como Z = p, o cálculo pode ser feito pela equação já conhecida, em que:
A = p + n
A = 60 + 88
A = 148
Como já comentado, podem existir questões que forneçam o valor de A. Dessa forma, o objetivo do exercício passa a ser calcular uma das outras duas grandezas. Partindo da equação de A = p + n é possível realizar o cálculo de qualquer uma delas.
Número de massa X número atômico
Esses dois termos são muito confundidos, porém indicam coisas diferentes. O número de massa é equivalente à soma da quantidade de prótons e nêutrons no núcleo atômico. Quando elementos diferentes possuem o mesmo número de massa, eles são conhecidos como isóbaros. Por outro lado, o número atômico é a quantidade de prótons dos átomos e corresponde à identidade dos elementos químicos, visto que dois elementos diferentes não podem ter o mesmo Z.
Vídeos sobre os números de massa dos elementos químicos
Agora que o conteúdo já foi apresentado, veja alguns vídeos selecionados para ajudar a assimilar o tema do estudo.
Tudo sobre o número de massa
Frequentemente, o número de massa é confundido com o valor da massa atômica dos elementos. Para não ter dúvidas sobre essas duas características, veja esse vídeo e entenda definitivamente, com a explicação e os exercícios resolvidos, o que é o número de massa e qual a diferença que existe entre ele e a massa atômica.
Diferença entre as características atômicas
O valor do número atômico de um elemento químico é igual ao número de prótons dele. Por outro lado, o número de massa, corresponde à soma de prótons e nêutrons. Veja detalhadamente a diferença entre cada uma dessas características atômicas e aprenda a realizar os cálculos necessários.
Exercício de cálculo dos números de massa e atômico
Em muitas questões de provas e vestibulares, esse conteúdo é cobrado em conjunto com o de número atômico. Portanto, veja esse exemplo de questão e saiba calcular as grandezas A e Z para íons e átomos em seus estados elementares, ou seja, eletronicamente neutros.
Em síntese, o número de massa de um elemento químico corresponde à soma de seus prótons e nêutrons presentes no núcleo atômico. Não pare de estudar por aqui, veja também sobre a radioatividade, ou seja, um efeito atômico que acontece no núcleo dos átomos.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica(1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Número de massa. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/numero-de-massa. Acesso em: 08 de July de 2025.
1. [PUC-MG (2007) - adaptada]
O íon Y3− tem 38 elétrons e 45 nêutrons. O átomo neutro Y apresenta número atômico e número de massa, respectivamente:
a) 35 e 80.
b) 38 e 83.
c) 41 e 86.
d) 45 e 80.
e) 35 e 86.
Como Y3− tem 38 elétrons, isso indica que o átomo neutro recebeu 3 elétrons, então, Y tem ao todo 35 elétrons. Essa quantidade de elétrons é igual à quantidade de prótons e, consequentemente, ao número atômico (Z = 35).
Como o número de nêutrons é 45, seu número de massa é, portanto:
A = p + n
A = 35 + 45
A = 80.
A alternativa correta é a letra a) 35 e 80.
2. [FEI-SP]
Um cátion metálico trivalente tem 76 elétrons e 118 nêutrons. O átomo do elemento químico, do qual se originou, tem número atômico e número de massa, respectivamente:
a) 76 e 194.
b) 76 e 197.
c) 79 e 200.
d) 79 e 194.
e) 79 e 197.
Como o átomo é trivalente, ele possui uma carga 3+, ou seja, o átomo neutro de origem perde 3 elétrons. Se o cátion tem 76 e–, o átomo neutro tem 79 e–. Z = p = e, portanto Z = 79. Seu número de massa é calculado pela equação, sabendo o valor de n, que é 118 nêutrons:
A = p + n
A = 79 + 118
A = 197.
Sendo assim, a alternativa correta é a letra e) 79 e 197.