Na química, não se tinha um acordo no que diz respeito à medida de quantidade de matéria até o surgimento do termo conhecido como mol. Seu uso veio para simplificar a linguagem química e para universalizar a maneira como nos referimos às enormes quantidades de átomos que fazem parte de tudo que podemos imaginar.
Publicidade
O que é mol?
Mol é o nome da unidade de medida no Sistema Internacional de Unidades (SI) para a grandeza de quantidade de matéria, representada por n. A quantidade de matéria diz respeito a quantidade de entidades elementares (átomos, moléculas, íons, elétrons ou partículas, dependendo do contexto) presentes em uma amostra ou sistema. O mol é muito utilizado na química como forma de simplificar as representações de proporções e no cálculo de concentrações, por ser uma maneira “mensurável” de apontar coisas infinitamente pequenas que não seriam possíveis de medir, como os átomos, por exemplo.
Relacionadas
O termo “mol” tem origens no latim, que significa “quantidade”. Foi um conceito proposto pela primeira vez pelo químico alemão Wilhem Ostwald, em 1896. Mol pode ser comparado com as quantidades de dúzias (12 unidades de algo) ou resmas (500 unidades). Neste sentido, um mol diz respeito a uma quantidade fixa de unidades, as entidades elementares. Um mol é exatamente igual a 6,022×1023 entidades elementares. Ou seja, um mol de carbono possui 602 sextilhões de átomos de carbono ou um mol de água (H2O) possui exatamente 6,022×1023 moléculas de água.
O mol, como dito, é muito utilizado na química na hora de realizar o cálculo de massas de substâncias necessárias em reações químicas, do volume dos componentes de uma solução com concentração determinada, entre outros. Vamos ver a seguir como calcular a quantidade de matéria e a relação existente entre mol, massa e volume.
Como calcular a quantidade de matéria?
Quando estamos falando da massa de 1 mol de qualquer átomo nos referimos à massa molar (M) do elemento, na unidade de gramas por mol (g/mol). Por convenção, a massa molar dos elementos químicos é exatamente igual à massa atômica, representado pela unidade de massa atômica (u) deles. Desta forma, a massa molar do Cálcio (Ca = 40 u) é igual a 40 g/mol.
Sendo assim, a quantidade de matéria (n) – ou número de mol – é utilizada para calcular quantos mols existem em uma determinada massa de algum elemento químico ou substância. É calculado pela seguinte equação:
Publicidade
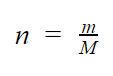
Em que,
- n: número de mol da substância a ser determinada, em mol;
- m: massa exata dada da substância, em g;
- M: massa molar da substância, em g/mol;
Por exemplo, queremos descobrir o número de mol de cloreto de sódio (NaCl = 58,5 u) presente em uma amostra de massa igual a 100 g do sal. Para isso, sabemos que a massa atômica do NaCl é exatamente igual à sua massa molecular, portanto M = 58,5 g/mol. Desta forma, utilizando a equação 1:
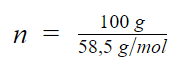
Em 100 g de NaCl, há 1,71 mol do sal presente.
Publicidade
Mol, massa e volume
Relação de mol e massa
De maneira análoga ao que foi visto anteriormente, a relação entre mol e massa é proporcional à massa atômica dos elementos ou massa molecular das demais substâncias:
Exemplo: Elemento carbono (massa atômica: 12 u)
Um mol de carbono apresenta 6,022×1023 átomos de carbono. Então um mol de carbono pesa 12 g.

Outro exemplo Substância ácido acético (CH3COOH) (massa molecular: 60 u)
Um mol de ácido acético apresenta 6,022×1023 moléculas de CH3COOH. Então um mol de ácido acético pesa 60 g.
Relação de mol e volume
Quando algum elemento ou composto se encontra no estado gasoso, nas condições normais de temperatura e pressão (CNTP), é possível determinar o volume que a matéria ocupa, em qualquer quantidade molar. Isso só é possível por conta da relação que existe entre quantidade de matéria e volume, que é a de que a matéria no estado gasoso ocupa sempre o mesmo espaço, de 22,4 L.
Exemplo: Elemento Hélio (He: 4 u)
O hélio é um gás nobre, portanto sua forma monoatômica (He) é encontrado naturalmente como um gás. Sabendo que um mol de hélio possui 6,022×1023 átomos de hélio e que esse mol de He tem massa igual a 4 g, o volume ocupado por essa quantidade de matéria é de 22,4 L. Em outras palavras, um balão preenchido com exatamente 22,4 L de hélio é um balão com um mol de hélio.

A razão entre o número de mol de uma substância e o volume de uma solução (V) (equação 2) é utilizada para a determinação da concentração das soluções, dada na forma de concentração molar (C).
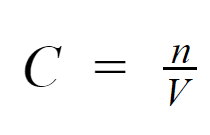
Vídeos para fixar o conceito de mol e suas relações com volume e massa
Abaixo veremos alguns vídeos explicativos que resumem de maneira didática tudo que vimos até agora sobre o mol e suas relações de massa e volume.
O que é um mol?
Um vídeo complementar com exemplos de reações químicas para exemplificar o que é um mol de maneira didática.
O conceito do mol
Uma maneira mais rápida e resumida para compreendermos o que é o mol.
Exercícios envolvendo Mol, Massa Atômica e átomos
Neste vídeo, a professora Patrícia elucida tintim por tintim como resolver exercícios.
Recapitulando, o conceito de mol é muito empregado na química. Seu uso vai desde a representação da massa de átomos dos elementos até a forma universalizada para a notação da concentração de soluções preparadas em laboratório. Não pare seus estudos, veja um pouco mais sobre massa molar.
Referências
Atkins & Jones. Princípios de Química – Questionando a vida moderna e o meio ambiente. 5a ed. Porto Alegre: Bookman, 2012.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Mol. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/mol. Acesso em: 31 de March de 2025.
1. [FUVEST-SP]
A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
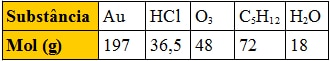
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au
b) HCl
c) O3
d) C5H10
e) H2O
Alternativa e) H2O.
Considerando que a quantidade de mols pode ser obtida por
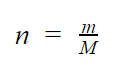
concluímos que, em igualdade de massa (m), a substância que tiver menor massa molar (M) terá maior número de moléculas (inversamente proporcionais). De acordo com a tabela, a que apresenta menor massa molar é a água. Portanto é a que apresenta maior número de moléculas.
2. [FCA-PA]
O número de mols existentes em 160 g de hidróxido de sódio (NaOH) é: Dados: Na = 23 u; O = 16 u; H = 1 u.
a) 2,0 mol
b) 3,0 mol
c) 4,0 mol
d) 5,0 mol
e) 6,0 mol
A massa atômica do NaOH é igual a (23 + 16 + 1) u, ou seja, 40 u. Esse valor é o valor de sua massa molar também, mas em g/mol. A partir da equação
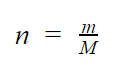
Podemos calcular qual é o numero de mol de NaOH:
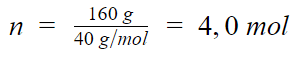
Portanto, a alternativa correta é a letra c) 4,0 mol