O átomo, menor unidade de matéria que constitui um elemento químico, sempre foi motivo de discussão entre físicos e químicos. Com o intuito de melhorar o modelo atômico na época, o físico dinamarquês, Niels Bohr deu continuidade aos trabalhos de Ernest Rutherford. Seu modelo apresenta os elétrons em órbitas ao redor de um núcleo.
Publicidade
O que é o modelo atômico de Bohr?
O modelo atômico de Bohr, também é chamado de átomo de Rutherford-Bohr por ter sido um aprimoramento da última teoria proposta por Rutherford. Este dizia que o átomo fazia parte de um “sistema planetário”, em que os elétrons circulam livremente em torno do núcleo. Porém, essa teoria não entrava em acordo com as mecânicas clássica e quântica, por conta disso havia algumas falhas.
Pensando nisso, Bohr sugeriu que os elétrons só podem circular o núcleo em órbitas com energias definidas, ou seja, as energias eram quantizadas. Isso implica que os elétrons se encontram em camadas ao redor do núcleo do átomo (K, L, M, N, O, P e Q). Quanto mais longe do núcleo, maior é a energia de uma camada eletrônica. Além de que os elétrons absorvem energia passando para um nível excitado e emitem (na forma de radiação) ao retornarem para o estado fundamental.
Relacionadas
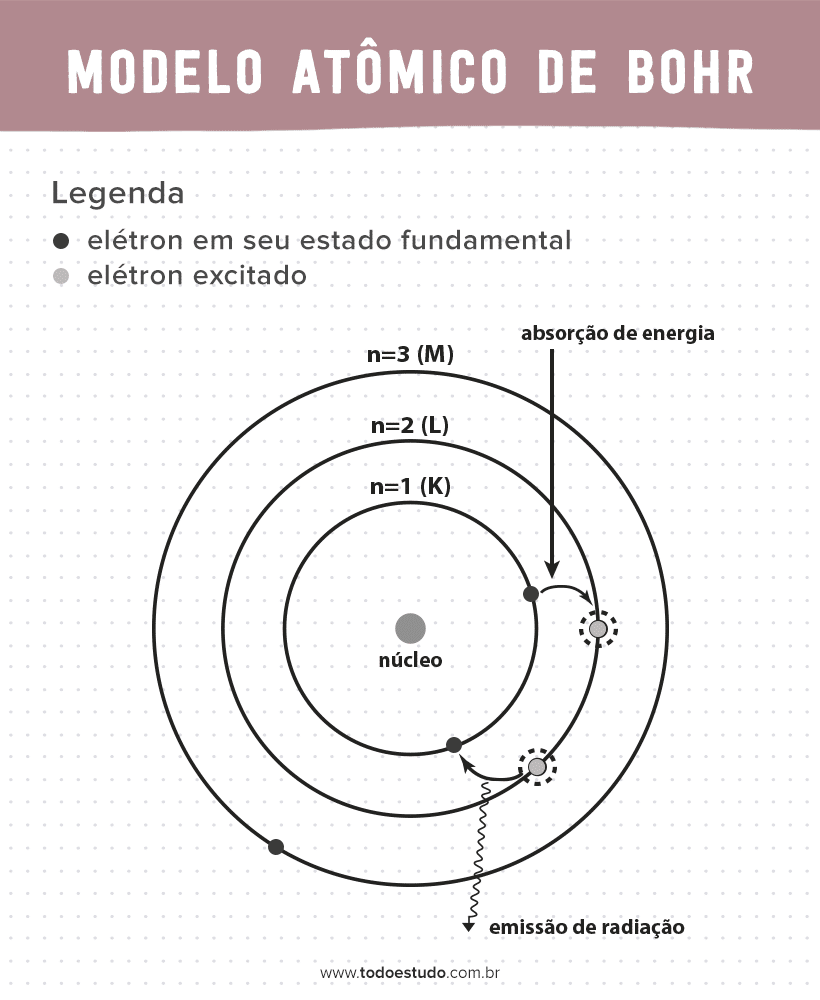
Ainda assim, o modelo atômico de Bohr não era perfeito. Ele fez a dedução baseada no átomo de hidrogênio, ou seja, para sistemas com apenas um elétron (como o hidrogênio), sendo invalidada para sistemas mais complexos por conta das interações entre os próprios elétrons. Outro motivo que inviabiliza a teoria de Bohr é de que as ligações químicas não eram explicadas e também por ir contra o princípio da incerteza de Heisenberg (que diz respeito à imprecisão na determinação de momento ou posição de uma partícula pequena como o elétron). Apesar disso tudo, esse trabalho dele foi premiado com um prêmio Nobel de Física em 1922.
Postulados de Bohr
Dessa forma, Niels Bohr desenvolveu seu modelo atômico partindo de quatro postulados:
- Postulado 1: os elétrons rodeiam o núcleo atômico em órbitas estacionárias de níveis de energias quantizados. Implicando que não há uma possibilidade de o elétron orbitar entre dois níveis de energia próximos.
- Postulado 2: a energia total do elétron, isso é, a soma das energias cinética e potencial, não apresenta um valor aleatório, mas sim valores múltiplos de um quantum de energia (a menor quantidade de energia presente nos fenômenos físicos).
- Postulado 3: o elétron absorve energia e pula para um nível mais excitado. Quando volta para o estado fundamental, o elétron emite essa energia na forma de radiação.
- Postulado 4: as órbitas permitidas dependem de valores de momento angular orbital bem definidos e são designadas pelas letras de K a Q (em ordem alfabética)
Mesmo não explicando todos os átomos, o modelo de Bohr promoveu grandes avanços na área da física e química, principalmente quando se fala em termos da mecânica quântica.
Vídeos sobre o modelo atômico de Bohr
Para fixar o conteúdo explicado até aqui, veja alguns vídeos que nos mostram como o átomo foi proposto por Niels Bohr. Confira e anote tudo!
Publicidade
A evolução do átomo
Nesse vídeo muito ilustrativo, vemos como que o conceito de átomo foi aprimorado por Bohr, além de conhecermos os outros modelos propostos até chegarmos na ideia de órbitas estacionárias.
Video-aula sobre o átomo de Bohr
Publicidade
Nessa aula rápida temos um maior entendimento sobre os postulados de Bohr, além de visualizarmos como é possível usar o espectro de emissão de um átomo para caracterizá-lo.
Resumo: o átomo de Bohr
Aqui, de forma resumida, vemos como Bohr deduziu o átomo de hidrogênio. Com uma explicação didática e muito fácil de entender, essa aula vai te ajudar a fixar esse conteúdo.
Em síntese, Niels Bohr foi capaz de resolver um dos problemas envolvidos com o modelo atômico de Rutherford, sendo premiado com o prêmio Nobel em 1922 por conta de seu trabalho ao descrever o átomo de hidrogênio. Não pare seus estudos por aqui, veja também sobre átomo e a teoria atômica de Dalton.
Referências
Princípios de química: questionando a vida moderna e o meio ambiente – Atkins, P. W., Jones, L.
Modelo Atômico de Bohr – Grupo de Ensino de Física da Universidade Federal de Santa Maria.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Modelo atômico de Bohr. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/modelo-atomico-de-bohr. Acesso em: 04 de April de 2025.
1. [UFPR - 2009]
Segundo o modelo atômico de Niels Bohr, proposto em 1913, é correto afirmar:
A) No átomo, somente é permitido ao elétron estar em certos estados estacionários, e cada um desses estados possui uma energia fixa e definida.
B) Quando um elétron passa de um estado estacionário de baixa energia para um de alta energia, há a emissão de radiação (energia).
C) O elétron pode assumir qualquer estado estacionário permitido sem absorver ou emitir radiação.
D) No átomo, a separação energética entre dois estados estacionários consecutivos é sempre a mesma.
E) No átomo, o elétron pode assumir qualquer valor de energia.
A resposta correta é a alternativa A, já que esse foi o fato principal que distinguia a teoria de Bohr da teoria de Rutherford
2.
Bohr estabeleceu em sua teoria atômica que os elétrons giram em órbitas circulares denominadas níveis ou camadas ao redor do núcleo. Segundo ele, o átomo pode ter no máximo 7 camadas. Qual delas é a mais energética? Por quê?
As camadas propostas por Bohr eram: K, L, M, N, O, P e Q, sendo a K a mais próxima do núcleo. Dessa forma, como está mais afastada, a camada Q é a mais energética porque quanto mais longe, maior é a energia da camada em questão.