A isomeria óptica consiste em um tipo de isomeria em que quase todas as propriedades são idênticas, com exceção de uma. Um belo dia seus amigos afirmam tê-lo visto em uma festa, porém você estava viajando e não pode comparecer. Apesar das semelhanças, um detalhe chamou a atenção dos seus amigos: a pessoa é canhota, e você é destro. Pois aqui há um caso semelhante ao fenômeno da isomeria óptica. Acompanhe a matéria!
Publicidade
O que é isomeria óptica?
A palavra isomeria se refere a um conjunto de 2 ou mais compostos com a mesma fórmula molecular. Por exemplo, os compostos etanol (CH3CH2OH) e éter metílico (CH3OCH3), que apresentam a mesma fórmula molecular (C2H6O). Entretanto, essas duas moléculas diferem por conta do arranjo de seus átomos.
Na isomeria óptica, os dois compostos são iguais na composição e organização de seus átomos, diferindo apenas na orientação espacial dos átomos ligantes. Nessa situação, em uma das moléculas, os átomos se posicionam à direita, na outra, à esquerda – como se estivessem em frente ao espelho. Na configuração da molécula, o efeito dessa inversão resulta na diferença de propriedade óptica.

Relacionadas
Como identificar a isomeria óptica?
Para determinar se ocorre isomeria óptica em um composto, desenhe-o em perspectiva, isto é, em três dimensões, e, ao lado, desenhe o mesmo composto, porém de modo espelhado. Se as imagens não se sobreporem, há dois isômeros ópticos. Essa propriedade é conhecida como quiralidade, além disso, é facilmente identificada no dia a dia, por exemplo, uma mão sobre a outra.
A consequência desse fenômeno é que ambas as moléculas possuem as mesmas propriedades físicas e químicas, como densidade, temperaturas de fusão e ebulição, condutividade elétrica e térmica, solubilidade, ionização, caráter ácido ou básico etc., exceto pela atividade óptica. Enquanto um dos isômeros desvia um feixe de luz polarizado para a direita (dextrogiro ou +), o outro desvia o feixe para a esquerda (levogiro ou -) com o mesmo ângulo.
Publicidade
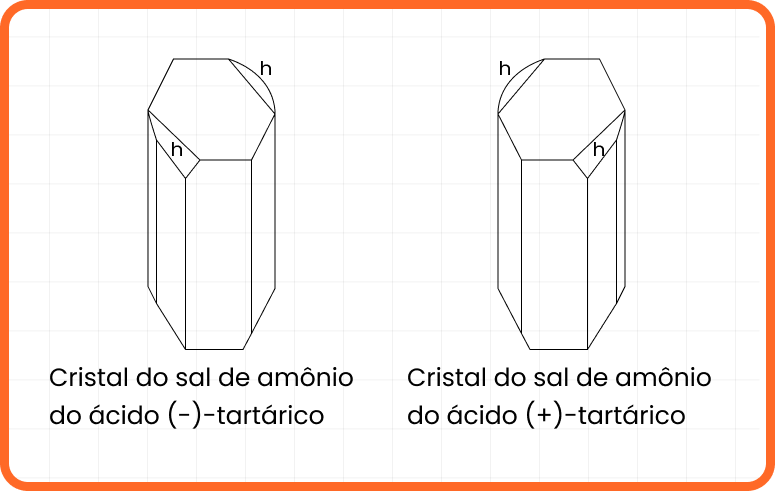
Exemplos de isomeria óptica
A natureza está repleta de moléculas que possuem assimetria, apresentando, assim, atividade óptica. Abaixo, confira exemplos desses compostos.
Ácido lático
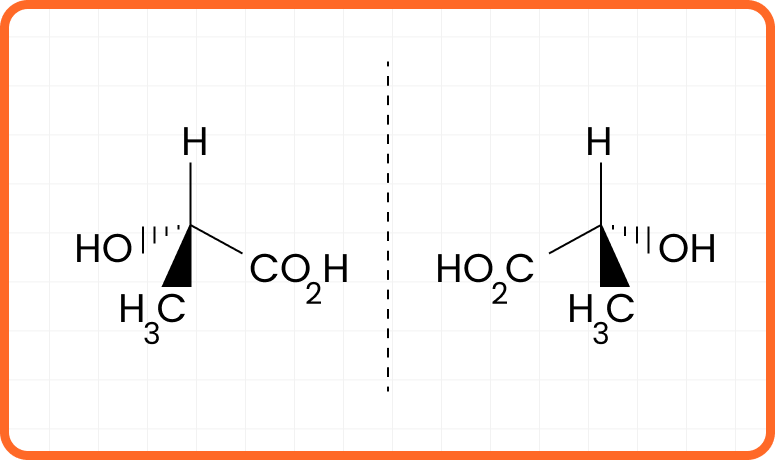
Quando o átomo de carbono realiza ligações simples, ele assume uma geometria tetraédrica, como ilustrado na figura. Observe que o átomo de carbono central se liga a 4 grupos diferentes, resultando em um centro de assimetria. Portanto, a molécula apresenta quiralidade.
Aspartame
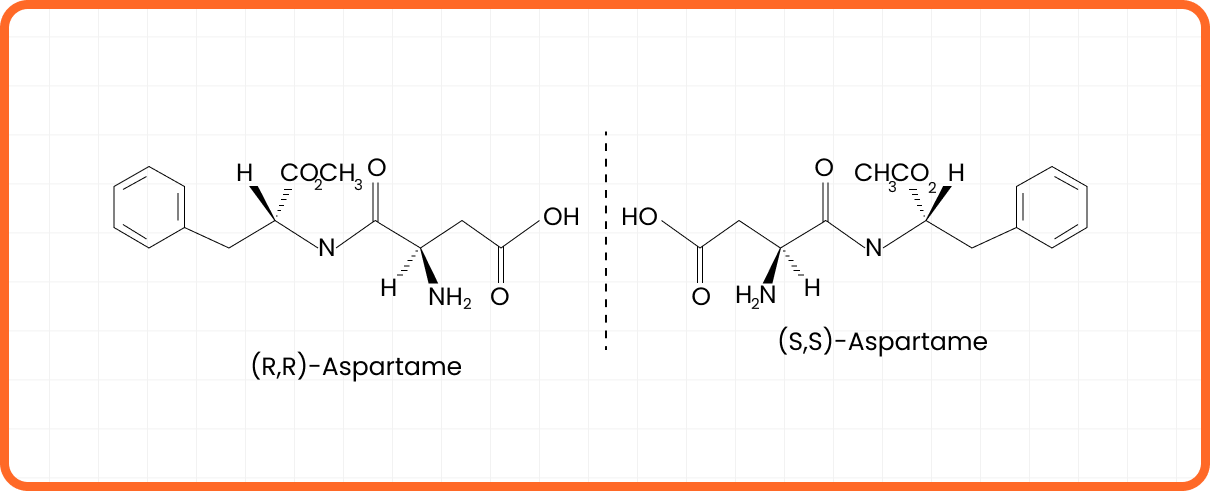
Assim como no caso anterior, o aspartame apresenta atividade óptica, pois existem centros de assimetria ao longo da cadeia carbônica. Esse exemplo ilustra a possibilidade de uma molécula conter mais de um centro assimétrico.
Publicidade
Talidomida
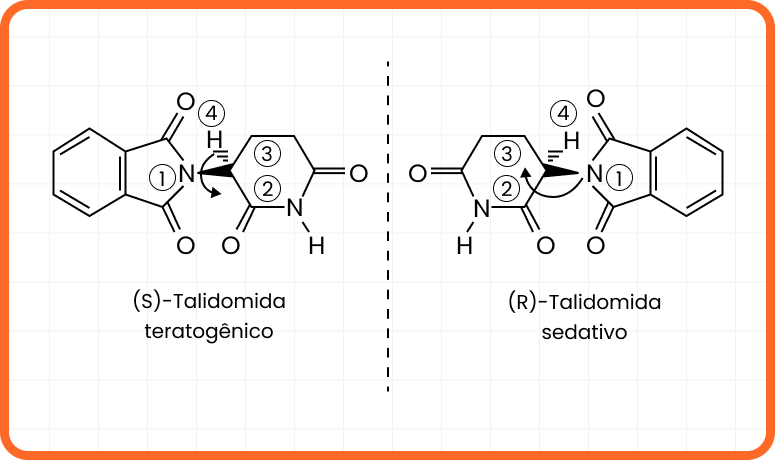
É um caso bastante conhecido dos efeitos, tanto farmacológicos quanto adversos, dos isômeros ópticos. Nos compostos com muitas semelhanças, o simples fato deles não apresentarem os grupos ligantes do mesmo lado implica em efeitos biológicos distintos.
No dia a dia, você se depara com vários casos de isomeria. Ela está presente nos alimentos, nos medicamentos, nos cosméticos e no corpo – a própria molécula de DNA apresenta quiralidade.
Recapitulando: principais pontos
Para identificar as moléculas que apresentam isomeria óptica, é necessário seguir alguns passos. São eles:
- Identificar um carbono assimétrico – ligado a 4 grupos diferentes.
- Escrever a estrutura da molécula – pode ser em 2D ou em 3D.
- Desenhar uma linha divisória ao lado da estrutura – servirá como plano especular.
- Representar a imagem especular do composto.
- Confirmar se não há assimetria.
Seguindo esses passos, você conseguirá identificar os compostos em que pode ocorrer isomeria óptica. Além disso, durante análise, escreva a fórmula estrutural da molécula, caso ela esteja representada por meio de sua fórmula molecular. Assim, será mais fácil perceber se há centro de assimetria e em qual átomo de carbono ele ocorre.
Videoaulas sobre isomeria óptica
Chegou a hora de aprofundar seu conhecimento! Nessa seleção de videoaulas, você verá representações bidimensionais dos compostos, que facilitam a visualização das imagens especulares. Além disso, há curiosidades e outras informações relacionadas a esse tipo de isomeria.
Isomeria óptica: uma introdução
A partir de fatos históricos, os professores contextualizam o processo de polarização da luz e do início dos estudos sobre compostos com atividade óptica. Também é realizada uma diferenciação entre a luz natural e a luz polarizada, bem como seus efeitos sobre a visão humana. Acompanhe!
Explicação ilustrativa sobre isomeria óptica
Nessa aula, o professor parte de uma discussão sobre o processo de polarização da luz e seu comportamento na presença de moléculas quirais. Ele fala brevemente sobre os compostos que apresentam isomeria geométrica, em que também pode ocorrer assimetria. Além de uma aula didática, toda a explicação é ilustrada em um quadro. Acompanhe!
Carbono assimétrico
Com uma linguagem bastante didática, o professor define o conceito de assimetria e a sua relação com as moléculas quirais. Para ilustrar esse tipo de isomeria, ele recorre às representações tridimensionais. Uma observação importante é feita sobre compostos cíclicos que também podem apresentar a propriedade de quiralidade.
A isomeria óptica é um fenômeno muito importante: ela está relacionada à existência da vida. Assim, alguns estudiosos apontam telescópios para a imensidão do espaço em busca de moléculas quirais. Enquanto tentam encontrar outras formas de vida no universo, estudo sobre carbono quiral.
Referências
COELHO, F.A.S. Fármacos e quiralidade. Cadernos Temáticos de Química Nova na Escola, n. 3, p. 23-32, 2001.
BAGATIN, O.; SIMPLÍCIO, F.I.; SANTIN, S.M.O.; FILHO, O.S. Rotação de luz polarizada por moléculas quirais: uma abordagem histórica com proposta de trabalaho em sala de aula. Química Nova Na Escola, n. 21, 34-38, 2005.
FELTRE, R. Química. Vol. 3. 6. ed. São Paulo: Moderna, 2004. p. 188-196.

Por Ademar Vinicius Fagion Freitas
Graduando em Química pela Universidade Estadual de Maringá (UEM), com ênfase na área de ensino. Atua como professor de química no setor privado e como voluntário no Cursinho UEM. Curte ler, assistir filmes e séries nas horas vagas.
Fagion Freitas, Ademar Vinicius. Isomeria óptica. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/isomeria-optica. Acesso em: 31 de March de 2025.
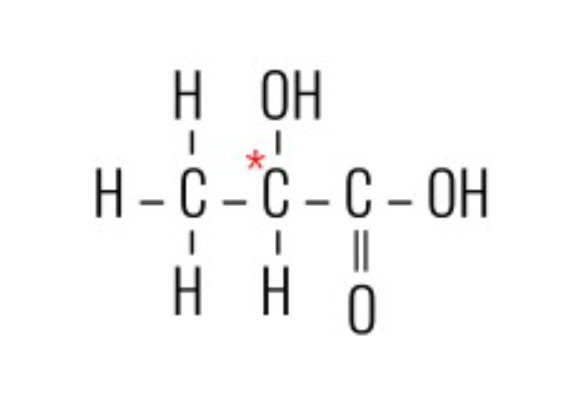
1. [PUC-MG]
O composto abaixo que se apresenta como molécula quiral é:
a) CH3COCOOH
b)CH3OCH2COOH
c) HOCH2COOH
d) CH3CHOHCOOH
e) CHOCOOH
Alternativa correta: D.
Ao desenhar a molécula, observa-se que o carbono indicado pelo asterisco se liga a 4 ligantes diferentes. Portanto, trata-se de um carbono assimétrico, resultando, assim, em uma molécula quiral.
2. [Fuvest-SP]
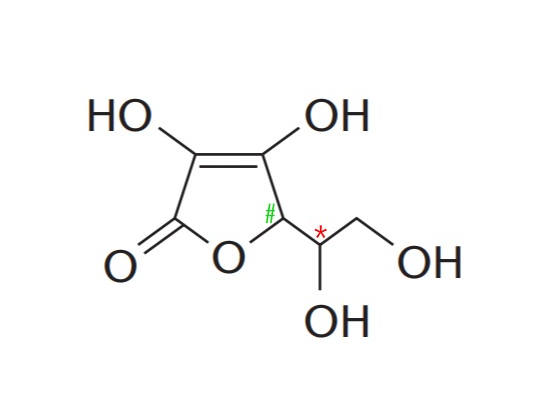
A molécula da vitamina C (ácido L-ascórbico) tem a fórmula estrutural plana abaixo.
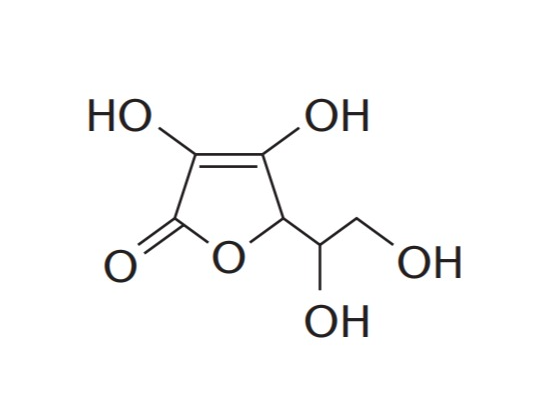
O número de grupos hidroxila ligados a carbono assimétrico é:
a) 0
b) 1
c) 2
d) 3
e) 4
Alternativa correta: B.
A molécula de vitamina C possui dois carbonos assimétricos, indicados pelos símbolos # (cerquilha) e * (asterisco). Contudo, apenas o carbono indicado pelo asterisco contém um grupo hidroxila (-OH) ligado.