O elemento carbono forma amplo número de compostos. Atualmente são conhecidos mais de 10 milhões de compostos químicos que contém este elemento, e cerca de 90% dos produtos sintetizados a cada ano são compostos contendo átomos de carbono.
Publicidade
A parte da química dedicada ao estudo dos elementos contendo carbono é chamada de química orgânica, que teve marco inicial com o trabalho de Friederich Wöller que em 1828 sintetizou a uréia a partir de materiais inorgânicos, quebrando a Teoria da Força Vital proposta pelos filósofos da Grécia Antiga. Diante do grande número de compostos químicos orgânicos, convenceu-se em organizá-los em famílias com semelhanças estruturais, tendo a classe mais simples representada pelos hidrocarbonetos.
“Hidrocarbonetos são compostos constituídos apenas de carbono e hidrogênio cuja característica fundamental é a estabilidade das ligações carbono-carbono.” (Brown, T., LeMay, E., Bursten, B., 2005, P. 606)
Tal tipo de estabilidade é devido ao fato do carbono ser o único elemento que forma cadeias, longas, átomos unidos por ligação covalente que podem ser simples, duplas ou triplas. Os hidrocarbonetos podem ser divididos em quatro tipos, conforme a espécie de ligação química carbono-carbono presente na molécula. As famílias (ou tipos) de hidrocarbonetos encontrados são:
Hidrocarbonetos saturados
1. Alcanos
Os alcanos são os hidrocarbonetos que possuem ligações simples, como, por exemplo, o etano C2H6. Por conterem maior número possível de átomos de hidrogênio são chamados de hidrocarbonetos saturados.
Estrutura dos alcanos
Cabe analisar a estrutura tridimensional dos alcanos por meio do modelo RPECV (Repulsão dos pares eletrônicos da camada de Valença), na qual podemos observar que em torno do átomo de carbono temos uma forma tetraédrica, com os grupos químicos ligados a cada vértice do tetraedro, constituindo assim uma ligação com hibridização sp3 do átomo de carbono.
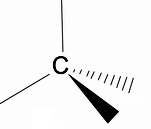
Outra característica estrutural importante dos alcanos é que a rotação de ligação carbono-carbono é permitida, fenômeno que acontece em altas temperaturas.
Publicidade
Isomeria estrutural dos alcanos
Alcanos são hidrocarbonetos que possuem átomos de carbono ligados uns aos outros, formando assim uma cadeia carbônica. Há as cadeias lineares, ou seja, os átomos de carbono são ligados sucessivamente em forma que lembra uma linha, contínua sem interrupções; e as cadeias ramificadas, cujos átomos de carbono possuem ramos, como se fosse um galho de árvore com um ramo de flor.
Na figura abaixo, usamos a fórmula C4H10 e percebemos a possibilidade de construirmos um composto de cadeia linear, representada pelo butano e outro composto de cadeia ramificada, representado pelo 2-metilpropano.
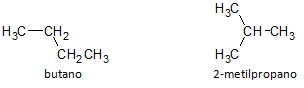
Publicidade
Notamos que nos casos acima, tivemos a mesma fórmula molecular para representar compostos diferentes, tendo assim o fenômeno de isomeria estrutural, pela qual os alcanos tem o mesmo número de átomos de carbono e hidrogênio, mas com propriedades físicas diferentes.
Nomenclatura dos alcanos
Convencionou-se uma regra para a nomenclatura dos compostos químicos, ditadas pela União Internacional de Química Pura e Aplicada, conhecida como IUPAC (em inglês International Union of Pure and Applied Chemistry), cujas regras são aceitas no mundo todo. A seguir, temos as regras para nomenclatura e seus procedimentos para compostos orgânicos alcanos.
a) Alcanos de cadeia linear usa-se o prefixo correspondente ao número de carbono presente na molécula.
b) Alcanos de cadeia ramificada determina-se a cadeia linear de átomos de carbono mais longa, e o nome dessa cadeia será o nome de base do composto. A cadeia mais longa pode não estar em linha reta como no exemplo a seguir:
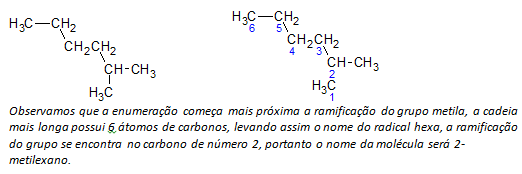
c) Alcanos de cadeia ramificada numeram-se os átomos da cadeia mais longa, começando pela extremidade mais próxima do substituinte.
No exemplo mencionado acima, começamos a enumeração pelo átomo de carbono na extremidade superior à esquerda, pois há um CH3 substituinte no segundo átomo de carbono da cadeia. Se o começo da enumeração fosse pelo átomo inferior à direita, o CH3 estaria num quinto átomo de carbono. Logo, enumera-se a cadeia de modo a dar os menores números possíveis para as posições dos substituintes.
d) Nomeando a localização de cada substituinte. O nome de um grupo formado pela remoção de um átomo de hidrogênio do alcano, ou seja, um grupo alquila é formado pela substituição ano do alcano correspondente pela terminação ila. Por exemplo, o grupo metila, CH3, vem do metano, CH4. O grupo etila, C2H5, vem do etano, C2H6. Logo, pelo exemplo (em b) o nome 2-metilexano indica a presença de um grupo metila, CH3, no segundo carbono da cadeia do hexano.
e) Nomeia-se substituintes em ordem alfabética, se forem dois ou mais. Quando dois ou mais substituintes forem idênticos, o numero deles é indicado pelos prefixos numéricos di, tri, tetra, penta, etc.
Hidrocarbonetos insaturados
2. Alcenos
Os alcenos são hidrocarbonetos insaturados com uma ligação dupla entre os carbonos, sendo o mais simples o eteno:
![]()
Estrutura dos alcenos
Pelo modelo RPECV, temos a dupla ligação dos alcenos, configurando assim uma ligação sigma (σ) e outra pi (π). A ligação π provém da superposição de lateral de dois orbitais p. Uma ligação covalente em que as regiões de superposição estão acima e abaixo do eixo internuclear, constituída por uma hibridização do tipo sp2 do átomo de carbono.
Nomenclatura dos alcenos
Os nomes dos alcenos estão baseados na cadeia mais longa de átomos de carbono que contenha a instauração (dupla ligação). O nome provém do alcano correspondente, tendo a terminação ano transformada em eno.
A localização da dupla ligação na cadeia é identificada pelo número de átomos de carbono que participa da dupla ligação e que está mais próximo da extremidade da cadeia, na qual esta é enumerada de modo a adquirir menor número possível.
Se a molécula tiver mais de uma instauração, cada qual será localizada por um número, onde a terminação do nome identifica o número de duplas ligações. Por exemplo, a molécula de 1,4-pentadieno é representada abaixo:
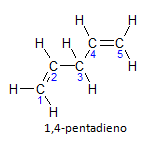
Observe que podemos enumerar os carbonos como na figura, temos que a instauração se encontra no carbono 1 e no carbono 4, logo a molécula apresenta duas insaturações, por isso o nome dieno, o radical penta representa a quantidade de carbonos na cadeia principal, que são 5.
Isomeria estrutural dos alcenos
Os alcenos possuem uma ligação do tipo sigma (σ) e outra do tipo pi (π), que configura uma rotação impedida da ligação, não podendo rotacionar o eixo como acontece com os alcanos. Dessa forma, os alcenos possuem um plano simétrico, aparecendo assim o fenômeno de isomeria geométrica, na qual pode haver variação na posição relativa do substituinte. Podemos citar como exemplo o composto 2-buteno, sua fórmula molecular é representada abaixo:
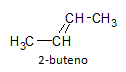
A molécula pode haver dois tipos de representação isomérica:
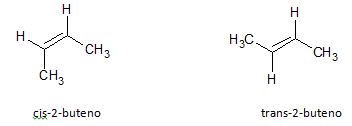
A molécula de 2-buteno pode assumir duas configurações geométricas diferentes, resultando assim em isômeros, diferem pela posição relativa dos dois grupos metila. São exemplos de isômeros geométricos, pois possuem mesmo número de átomos de carbono e hidrogênio como também a mesma posição da instauração, porém com disposição espacial dos grupos diferente. No isômero cis os grupos metila estão do mesmo lado da dupla ligação, enquanto no isômero trans os grupos metila estão de lados opostos um ao outro.
3. Alcinos
Os alcinos são hidrocarbonetos insaturados, possuem uma ligação tripla entre os carbonos, sendo o acetileno, mais simples:
![]()
Estrutura dos alcinos
Pelo modelo de REPCV, os alcinos possuem uma ligação sigma (σ) e duas ligações pi (π), todas do tipo covalente onde as ligações π se dispõem fora do eixo internuclear, fazendo com que as moléculas contendo tripla ligação sejam planas conferindo rigidez. As ligações triplas se explicam pela hibridização de orbitais, sendo do tipo sp para a formação de ligações σ, favorecendo uma geometria linear.
Nomenclatura dos alcinos
Os alcinos obedecem a mesma regra de nomenclatura apresentada pelos alcanos e alcenos, são denominados pela cadeia carbônica mais longe que contém a ligação tripla, e pela terminação ino em relação ao alcano correspondente. Podemos ilustrar por meio do exemplo dado pela molécula abaixo:
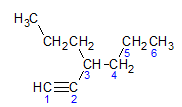
De acordo com o que aprendemos anteriormente, a cadeia mais longa teria sete átomos de carbono, no entanto tal cadeia não teria a ligação tripla. A cadeia carbônica mais longa com a ligação tripla possui seis átomos de carbono, então o composto leva o radical hexa, como possui uma ligação tripla, seu nome radicalar será hexino. Observamos que no carbono de número 3 há o radical propil, logo o nome do composto será 3-propil-1-hexino.
4. Hidrocarbonetos cíclicos e aromáticos
Os hidrocarbonetos que possuem cadeia fechada podem ser divididos entre os cíclicos e aromáticos. Hidrocarbonetos cíclicos possuem forma de anel, ou ciclo, normalmente representados por fórmulas geométricas. Podem ser constituídos por alcanos, alcenos e alcinos, levando o nome de ciclanos, ciclenos e ciclinos respectivamente. Exemplos de hidrocarbonetos cíclicos logo abaixo:
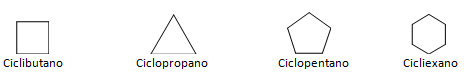
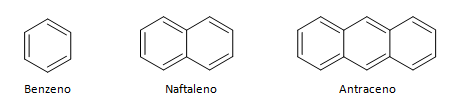
Hidrocarbonetos aromáticos são compostos que possuem três ligações duplas, também possui cadeia fechada. A estrutura mais comum dos aromáticos é representada pelo benzeno, uma molécula plana, simétrica, possui elevado grau de instauração. Normalmente é representado com um círculo ao meio para designar a deslocalização da ligação π, não é comum representar os átomos de hidrogênio dos aromáticos. A representação dos aromáticos pode também ser feita da maneira do exemplo a seguir, onde as ligações π são explícitas:
Referências
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Hidrocarbonetos. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/hidrocarbonetos. Acesso em: 31 de March de 2025.
1. [ENEM/2011] Moradores sobreviventes da tragédia que destruiu aproximadamente 60 casas no Morro da Bumba, na Zona Norte de Niterói – RJ, ainda defendem a hipótese de o deslizamento ter sido causado por uma explosão provocada por gás metano, visto que este local foi um lixão entre os anos de 1960 e 1980.
O gás mencionado no texto é produzido
a) Como subproduto da respiração aeróbia bacteriana.
b) Pela degradação anaeróbia de matéria orgânica por bactérias.
c) Como produto de fotossíntese de organismos pluricelulares autotróficos.
d) Pela transformação química do gás carbônico em condições anaeróbias.
e) Pela conversão, por oxidação química, do gás carbônico sob condições aeróbias.
2. [ENEM/2012] Em uma planície, ocorreu um acidente ambiental em decorrência do derramamento de grande quantidade de um hidrocarboneto que se apresenta na forma pastosa à temperatura ambiente. Um químico ambiental utilizou uma quantidade apropriada de uma solução de para-dodecil-benzenossulfonato de sódio, um agente tensoativo sintético, para diminuir os impactos desse acidente.
Essa intervenção produz resultados positivos para o ambiente porque:
a) Promove uma reação de substituição no hidrocarboneto, tornando-o menos letal ao ambiente.
b) A hidrólise do para-dodecil-benzenossulfonato de sódio produz energia térmica suficiente para vaporizar o hidrocarboneto.
c) A mistura desses reagentes provoca a combustão do hidrocarboneto, o que diminui a quantidade dessa substância na natureza.
d) A solução de para-dodecil-benzenossulfonato de sódio possibilita a solubilização do hidrocarboneto.
e) O reagente adicionado provoca uma solidificação no hidrocarboneto, o que facilita sua retirada do ambiente.
1. [B]
A questão diz que o Morro do Bumba foi um lixão entre os anos 1960 e 1980. Lixões e aterros sanitários são colônias de bactérias anaeróbias, que não dependem do oxigênio para respirar, tais bactérias sobrevivem em ambientes com a falta deste gás. Com a degradação da matéria orgânica, essas bactérias anaeróbias produzem o gás metano, CH4, altamente inflamável.
2. [D]
A molécula de p-dodecil-benzenossulfonato de sódio é um tensoativo sintético que contém um anel benzênico com uma substituição de grupo polar dada por SO3- e outro grupo apolar dada pelo radical dodecil, que consiste numa cadeia carbônica com 12 átomos de carbono ligados a hidrogênio, um hidrocarboneto:
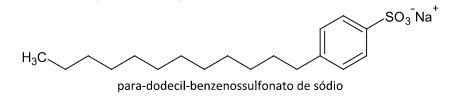
Hidrocarbonetos por possuírem apenas carbono e hidrogênio não são solúveis em água, pois não ocorre atração intermolecular do tipo pontes de hidrogênio, logo, o químico ambiental usou o tensoativo, pois dissolve o hidrocarboneto presente na água conforme o enunciado.
Sobre os tensoativos, por terem uma grande parte apolar e uma pequena parte polar (na molécula acima a parte polar é o grupo SO3–), essa parte tem atração com a água, formando assim uma micela, representada na figura abaixo:
Na figura, a parte verde é a parte polar e a parte vermelha a apolar correspondente a estrutura do hidrocarboneto. Hidrocarbonetos têm afinidade com outros hidrocarbonetos, dessa maneira, o poluente do corpo de água citado no enunciado ficaria envolto dentro da esfera da micela pois a parte polar do tensoativo está com contato com a água por forças dipolo, fazendo com que o hidrocarboneto seja solubilizado e o impacto ao ambiente seja minimizado.