As forças intermoleculares são variadas formas de interação entre moléculas (polares ou apolares) constituídas de ligações covalentes. Elas apresentam a sua forma de interação entre si, o que proporciona características típicas para tais.
Publicidade
O conceito acerca das forças intermoleculares fora proposto pelo físico-químico holandês Diderik Van der Waals, em 1872. Para o cientista, as moléculas interagiam de forma diferente uma das outras.
Além disso, a observação também abrangia uma influência destas interações no ponto de fusão (PF) e no ponto de ebulição (PE) de elementos. Dessa maneira, de acordo com a intensidade de interação das moléculas ao interagir, seu estado físico era definido.
É importante recordar que os estados físicos da matéria abrangem o sólido, o líquido e o gasoso. Para Van de Waals, a intensidade na interação das forças moleculares estaria diretamente relacionada ao estado físico de uma substância.
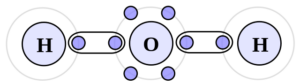
Os tipos de forças intermoleculares
Facilmente se notam as diferentes maneiras das forças intermoleculares agirem. Na natureza, por exemplo, é possível encontrar uma mesma matéria nos mais variados estados físicos.
Como supracitado, as forças intermoleculares serão uma peça-chave para definir tais formas de ação destas forças. Conheça, assim, os três tipos de forças intermoleculares que podem ser encontradas na natureza.
Forças de London
Também denominada como Dipolo induzido, esse tipo de força ocorrerá entre moléculas apolares. Dessa maneira, seriam moléculas que não apresentam carga positiva ou negativa.
Publicidade
Apesar dos elétrons estarem distribuídos uniformemente, em certo momento eles podem se acumular em um polo, formando um negativo e um positivo. Por estar próximo a outra molécula, ela induzirá essa reação em cadeia.
Por causa disso, as moléculas, antes apolares, passam a apresentar um dipolo induzido pela força molecular imposta. Exemplos: Gás Metano (CH4) e Gás Carbônico (CO2).
Força dipolo permanente
Também chamada de dipolo-dipolo, essa força abrange a força intermolecular que ocorre entre as moléculas polares. No entanto, é importante ressaltar que essas moléculas polares não abrangem o elemento hidrogênio ligado a flúor, oxigênio e nitrogênio.
Publicidade
Pelo fato de as moléculas serem polares, há uma intensa interação dos polos negativos com os positivos, em cadeia sucessiva. Exemplos: Ácido Cloídrico (HCl) e Ácido Bromídrico (HBr).
Ligações de Hidrogênio
É outro dos tipos de forças intermoleculares que ocorre entre moléculas polares. Diferentemente da dipolo-dipolo, esta apenas abrangerá a ligação entre as moléculas de hidrogênio e as moléculas mais eletronegativas da tabela periódica.
Assim, o hidrogênio irá fazer ligação com o Flúor, o Oxigênio e o Nitrogênio. É uma força intermolecular de alta intensidade, uma vez que a diferença de eletronegatividade entre os gigantes é a maior.
Exemplos: Amônia (NH3), Ácido Fluorídrico (HF) e Água (H2O).
Referências
SALVADOR, Edgard e USBERCO, João. Química, volume único. 1ª edição, Editora Saraiva, São Paulo-SP, 2006. 672 p.

Por Mateus Bunde
Graduado em Jornalismo pela Universidade Federal de Pelotas (UFPel), Especialista em Linguagens pelo Instituto Federal Sul-Rio-Grandense (IFSul) e Mestrando em Comunicação pela Universidade do Porto, de Portugal (UP/PT).
Bunde, Mateus. Forças Intermoleculares. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/forcas-intermoleculares. Acesso em: 01 de April de 2025.
01. [PUC] O dióxido de carbono, presente na atmosfera e nos extintores de incêndio, apresenta ligação entre os seus átomos do tipo……. e suas moléculas estão unidas por ……. .
Os espaços acima são corretamente preenchidos pela alternativa:
a) covalente apolar – forças de Van der Waals
b) covalente apolar – atração dipolo induzido-dipolo induzido
c) covalente polar – ligações de hidrogênio
d) covalente polar – forças de Van der Waals
e) covalente polar – atração dipolo-dipolo
02. [FAMECA-SP] Compostos HF, NH3 e H2O apresentam elevados pontos de fusão e de ebulição quando comparados a H2S e HCl, por exemplo, devido:
a) às forças de van der Waals;
b) às forças de London;
c) às ligações de hidrogênio;
d) às interações eletrostáticas;
e) às ligações iônicas.
03. [FGV] O conhecimento das estruturas das moléculas é um assunto bastante relevante, já que as formas das moléculas determinam propriedades das substâncias como odor, sabor, coloração e solubilidade. As figuras apresentam as estruturas das moléculas de CO2, H2O, NH3, CH4, H2S e PH3.
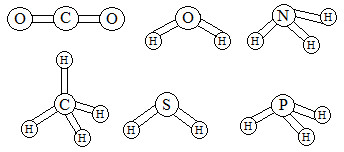
Estruturas de moléculas em exercícios sobre interações intermoleculares
Quanto às forças intermoleculares, a molécula que forma ligações de hidrogênio (pontes de hidrogênio) com a água é:
a) H2S.
b) CH4.
c) NH3.
d) PH3.
e) CO2.
01. [D]
02. [C]
03. [C]