Entalpia é a energia de determinado processo físico-químico que pode ser medida na forma de calor liberado ou absorvido por determinado sistema. No âmbito da termoquímica, ela é utilizada na medida desse calor envolvido nas reações químicas. Existem diferentes tipos de entalpia, que variam conforme a reação. Vamos ver mais sobre essa propriedade e seus tipos.
Publicidade
O que é entalpia
Representada pela letra H, a entalpia está relacionada com a quantidade de energia contida nas moléculas das entidades químicas envolvidas em reações. Sendo assim, a energia que estava contida nos reagentes da reação é liberada na forma de calor quando eles se transformam em produtos, medida na forma de variação (ΔH).
Relacionadas
É importante ressaltar a diferença entre os conceitos de entalpia e entropia, já que é muito comum acontecer confusões com os termos. A entalpia estuda a energia total de um sistema termodinâmico que pode ser removido na forma de calor, sendo assim, a ΔH corresponde ao calor envolvido no processo de transformação química que ocorrem à pressão constante. Já a entropia é uma grandeza termodinâmica associada ao grau de desordem de um sistema, é a medida da energia que não é transformada em trabalho, ou seja, a energia dissipada.
Variação de entalpia
Calcular a energia contida numa substância, ou seja, seu calor absoluto, não é possível experimentalmente, por isso, por convenção, a H é igual a zero nesses casos. Porém, em processos químicos, é possível calcular a variação da entalpia (ΔH) existente entre os produtos e os reagentes.
ΔH = HP – HR
- ΔH: variação de entalpia
- HP: entalpia dos produtos
- HR: entalpia dos reagentes
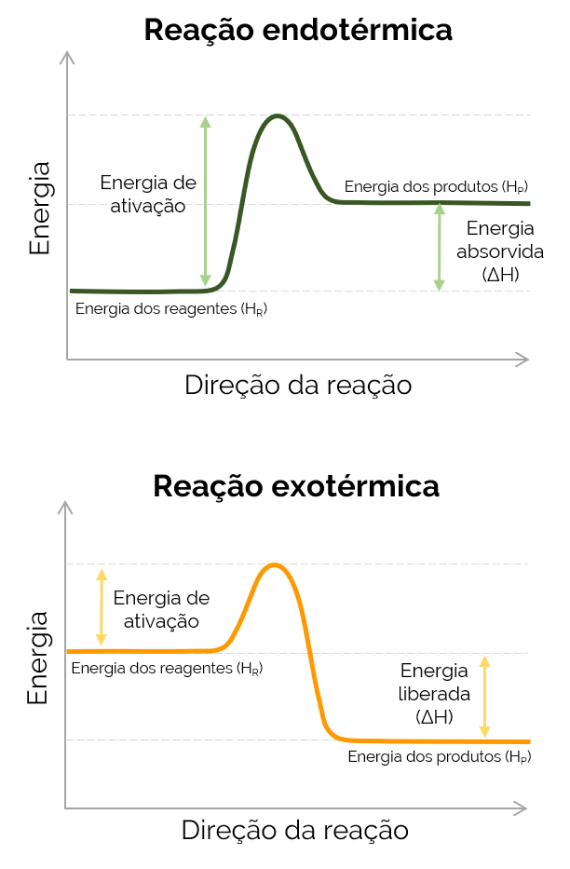
Quando a entalpia dos produtos for maior que a dos reagentes (HP > HR), a ΔH é positiva e a reação que ocorre é endotérmica e há a absorção de calor, ou seja, se for uma reação acontecendo em um frasco, esse recipiente ficará gelado. Por outro lado, quando a ΔH é negativa, a reação é exotérmica e há a liberação de calor. Nesse caso, a HP < HR.
Publicidade
Tipos de entalpia
Como dito anteriormente, existem diferentes tipos de entalpia conforme o processo físico-químico que ocorre. Vamos ver agora, brevemente, sobre cada um deles.
- Calor de formação: calor envolvido na formação de 1 mol de substância a partir de outras substâncias simples no estado padrão (com H = 0).
- Entalpia de combustão: energia liberada na queima, ou combustão completa de 1 mol de composto, desde que este esteja no estado padrão.
- Entalpia de ligação: é a energia necessária para romper 1 mol de ligações químicas entre dois átomos no estado gasoso.
- Calor de dissolução: liberação ou absorção de calor associado a dissolução completa de 1 mol de soluto, geralmente sais iônicos como o NaCl, em solvente adequado.
Além desses, existem as entalpias de transformação de estado físico, ou seja, aquelas que correspondem a energia relacionada à mudança de uma substância do estado sólido para o líquido (fusão) ou do estado líquido para o gasoso (vaporização)
Cada um desses processos que envolvem o calor durante as reações químicas podem ter os valores de ΔH calculados partindo de dados fornecidos previamente e pela equação mostrada acima. Além disso, a entalpia é de grande importância em laboratórios químicos. A de combustão, por exemplo, é utilizada na determinação de calorias de alimentos em um equipamento chamado calorímetro.
Publicidade
Vídeos sobre o fenômeno de liberação de energia térmica
Agora que sabemos o que é a entalpia, vamos assistir alguns vídeos que nos ajudem a assimilar o conteúdo estudado.
Conceitos e definições
A entalpia é também definida como calor que é fornecido ou liberado por um sistema. Ela é um dos assuntos estudados na termoquímica. Além desses, existem alguns que são importantes conhecer para dominar a matéria. Aprenda tudo sobre a parte introdutória da termoquímica.
Quais os tipos de entalpia que existem
A entalpia pode ser dividida em algumas categorias conforme a reação química que está acontecendo. Pode ser a de combustão, de formação, de dissolução, além de outras. Aprenda e veja exemplos de reações químicas e as formas de liberação de energia envolvidas em cada processo.
Exercício de cálculo do ΔH de uma reação
Em termoquímica, um dos exercícios mais comuns que são cobrados em provas e vestibulares é o do cálculo de ΔH de uma reação. Uma forma de realizar isso é a partir da ΔHformação. Com esse vídeo, temos um exemplo e exercícios resolvidos para realizar o cálculo do ΔH de reações pelo calor de formação dos produtos.
Por fim, vimos que a energia térmica envolvida em reações químicas é chamada de entalpia, importante para determinar se uma reação é endo ou exotermica. Não deixe de estudar aqui, saiba mais também sobre a primeira lei da termodinâmica que trata das trocas de energia na forma de calor e trabalho.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Físico-Química (1986) – Gilbert Castellan

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Entalpia. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/entalpia. Acesso em: 02 de April de 2025.
1. [UNICAMP - 2018]
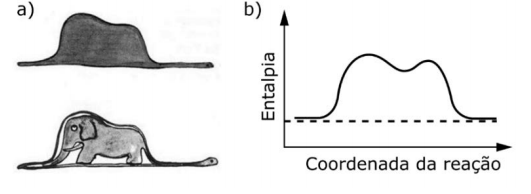
O livro ”O pequeno príncipe”, de Antoine de Saint-Exupéry, uma das obras literárias mais traduzidas no mundo, traz ilustrações inspiradas na experiência do autor como aviador no norte da África. Uma delas, a figura (a), parece representar um chapéu ou um elefante engolido por uma jiboia, dependendo de quem a interpreta.
Para um químico, no entanto, essa figura pode assemelhar-se a um diagrama de entalpia, em função da coordenada da reação (figura b). Se a comparação for válida, a variação de entalpia dessa reação seria:
- Praticamente nula, com a formação de dois produtos.
- Altamente exotérmica, com a formação de dois produtos.
- Altamente exotérmica, mas nada se poderia afirmar sobre a quantidade de espécies no produto.
- Praticamente nula, mas nada se poderia afirmar sobre a quantidade de espécies no produto.
Observando o gráfico representado na figura b, a linha que representa a variação de energia da reação é igual no início e no final do processo. Sendo assim é possível afirmar que a variação de entalpia (ΔH) será zero, ou praticamente nula. Ainda assim, como não existe uma equação da reação descrita, nada se pode ser dito com relação a quantos produtos ou reagentes estão envolvidos. Alternativa d.
2. [FUVEST - SP]
Quando 0,500 mol de etanol líquido sofre combustão total sob pressão constante, produzindo CO2 e H2O gasosos, a energia liberada é de 148 kcal. Na combustão de 3,00 mol de etanol, nas mesmas condições, a entalpia dos produtos, em relação à dos reagentes, é:
- 74 kcal menor.
- 444 kcal maior.
- 444 kcal menor.
- 888 kcal maior.
- 888 kcal menor.
Como a entalpia de formação é proporcional ao número de mol dos produtos e reagentes envolvidos, temos:
C2H5OH (l) + 3 O2(g) → 2 CO2(g) + 3 H2O(g)
Para 0,500 mol, ΔH= 148 kcal. Com uma regra de três, descobrimos a ΔH da combustão de 3,00 mol de etanol.
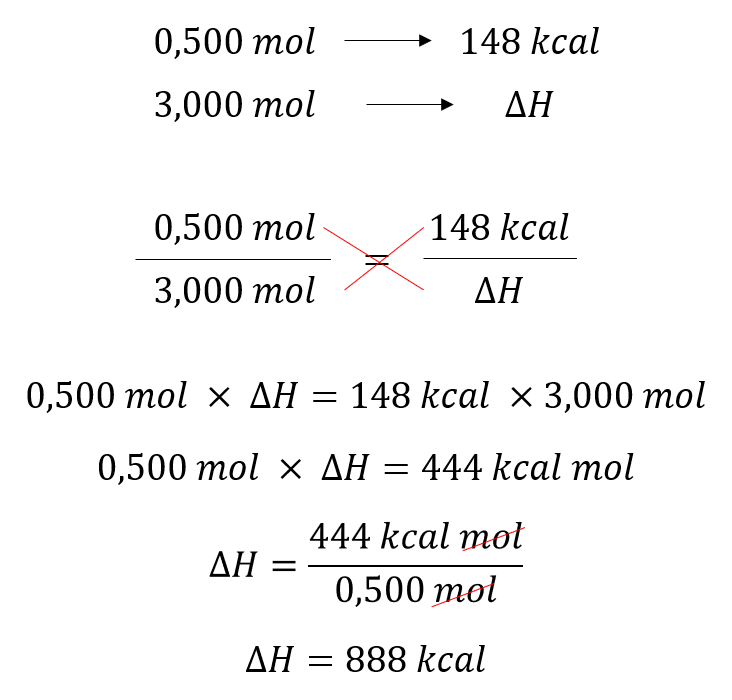
Portanto, a resposta correta é a alternativa d, 888 kcal maior