O potencial ou energia de ionização está relacionado às características individuais de cada átomo e segue um padrão. No decorrer da matéria, entenda o conceito, como é feito o cálculo e confira exemplos.
Publicidade
O que é a energia de ionização?
O potencial de ionização consiste em uma tendência dos átomos de terem um ou mais elétrons removidos, resultando, assim, em ionização. Em outras palavras, trata-se de converter um átomo, no estado neutro, em um íon positivo, chamado de cátion. Essa conversão ocorre por meio da remoção de um ou mais elétrons das camadas mais externas do átomo.
Para se caracterizar como energia de ionização, é necessário que o átomo se encontre em sua forma neutra, ou seja, com todos os seus elétrons, e no estado gasoso. Essa etapa é importante para não resultar em erros de medição, pois, ao adicionar energia em um conjunto de átomos neutros no estado sólido, por exemplo, ocorrerá a fusão e, em seguida, a vaporização dessa amostra para, então, ocorrer a ionização. Portanto, parte dessa energia é empregada na mudança de estado físico.
Relacionadas
Energia de ionização: primeira X segunda
A primeira energia de ionização consiste na quantidade mínima de energia necessária para remover o elétron mais afastado do núcleo de um átomo em seu estado neutro. Assim, forma-se um cátion.
Já a segunda energia de ionização consiste na remoção de um segundo elétron mais afastado do núcleo, porém, não mais do átomo neutro, e,sim, do cátion formado anteriormente. Esse processo resulta na formação de um cátion bivalente (com duas cargas positivas).
Publicidade
A energia de ionização pode ser representada pela seguinte equação: A(g) + Energia → A+(g) + e–. Da mesma forma, a remoção de um segundo elétron desse íon pode ser representada como: A+(g) + Energia → A2+(g) + e–.
Os dois casos apresentados se configuram como a primeira e a segunda energia de ionização, que são diferentes. Para remover o primeiro elétron a partir do átomo neutro, é necessário empregar uma quantidade de energia menor.
Após a formação do íon, o núcleo do átomo atrai os elétrons remanescentes com mais força, pois, nesse cenário, há um elétron a menos para ser atraído. Sendo assim, para remover um segundo elétron, será necessária uma quantidade maior de energia.
Publicidade
De modo geral, a segunda energia de ionização tende a ser aproximadamente o dobro da primeira energia de ionização. Além disso, ela pode variar dependendo da distribuição dos elétrons ao redor dos átomos. Assim, podemos estabelecer a seguinte ordem para as energias de ionização: E1 < E2 < E3 < … En.
Como calcular a energia de ionização?
Os valores de energia de ionização se encontram em livros e manuais técnicos. Eles são especificados em relação ao tipo de elétron removido (primeiro, segundo etc.) e ao elemento químico correspondente.
Para ter noção de qual elétron se trata e do possível elemento correspondente, é necessário fazer uma comparação entre determinado valor de energia de ionização (segundo, terceiro, quarto etc.) e o valor anterior (primeiro, segundo, terceiro etc.).
Por exemplo, no caso do elemento sódio, o valor da segunda energia de ionização é 4 562 kJ/mol, já o valor da primeira é de 496 kJ/mol. A diferença entre esses dois valores é de 4 066 kJ. Isso sugere que o sódio tende a ionizar apenas 1 elétron, formando o cátion Na+.
Esse raciocínio pode ser aplicado para outros casos, pois, se a diferença entre um valor de energia e o seguinte for aproximadamente o dobro (3 ou 4 vezes maior), o átomo tende a perder apenas o elétron correspondente ao menor valor, como no caso do sódio.
Energia de ionização e a tabela periódica
Na tabela periódica, é possível verificar vários padrões de comportamento dos elementos químicos, incluindo uma tendência de variação na energia de ionização dos átomos. Os metais, por exemplo, tendem a apresentar potenciais de ionização relativamente baixos quando comparados aos não metais.
O potencial de ionização tende a aumentar nos períodos da esquerda para a direita, indo em direção aos gases nobres, e de baixo para cima nas famílias em direção aos elementos que estão no topo. Observe a imagem:
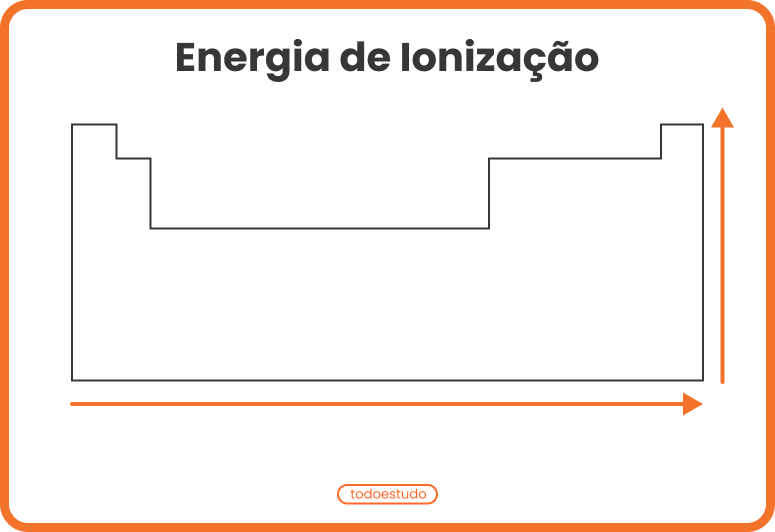
Quanto menor for a quantidade de elétrons na camada de valência do átomo, menor será a quantidade de energia necessária para remover o elétron, em comparação com os elementos à direita no mesmo período. Contudo, esse valor será maior do que um elemento logo abaixo na mesma família. Por exemplo, a primeira energia de ionização do potássio é maior do que a do rubídio, assim como a primeira energia de ionização do magnésio é maior do que a do cálcio.
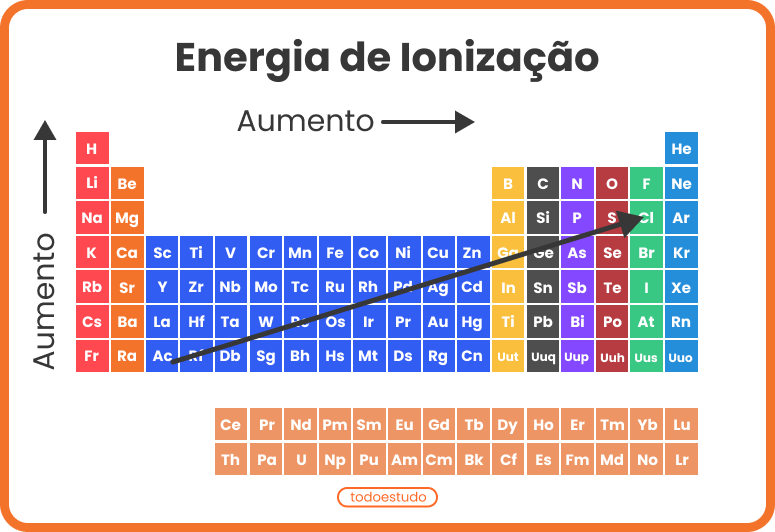
Nas imagens, é possível observar o potencial de ionização nos elementos da tabela periódica. Para compreender melhor esse tipo de energia, no próximo tópico, confira exemplos.
Exemplos de energia de ionização
Alguns elementos apresentam um comportamento bastante peculiar e fogem um pouco da tendência periódica que se esperava. Abaixo, acompanhe casos de energia de ionização que tanto se adéquam ao modelo quanto se distanciam.
- Hélio: trata-se do elemento com o maior valor de potencial de ionização, em torno de 2 372 kJ/mol. Essa é uma das razões que o torna praticamente não reativo.
- Césio: em oposição ao primeiro, o césio consiste no elemento com o menor potencial de ionização já medido. Esse valor gira em torno de 376 kJ/mol e contribui para a elevada reatividade do metal.
- Oxigênio: por mais estranho que pareça, seu potencial de ionização é menor em comparação ao nitrogênio – próximo de 1 314 kJ/mol para o oxigênio e de 1 402 kJ/mol para o nitrogênio. Isso se deve ao fato do oxigênio apresentar um par de elétrons emparelhados, assim, o efeito de repulsão entre os elétrons torna sua remoção menos energética.
- Magnésio: é o segundo elemento da família dos metais alcalinos-terrosos com o maior valor de potencial de ionização, cerca de 738 kJ/mol para a remoção do primeiro elétron e 1 451 kJ/mol para remover um segundo elétron. O magnésio também se apresenta bastante reativo.
- Alumínio: dos elementos do segundo período, ele perde apenas para o sódio, com o menor valor de energia de ionização. A energia necessária para remover o primeiro elétron do alumínio é de 578 kJ/mol e, para o segundo, é de 2 745 kJ/mol.
Tais casos servem para ilustrar o comportamento de alguns dos elementos mais conhecidos da tabela periódica. Por meio deles, é possível compreender como segue a tendência geral da energia de ionização.

Energia de ionização X energia de remoção
A energia de remoção é o termo utilizado em Portugal e em outros países que falam a Língua Portuguesa para se referir à energia de ionização, como é conhecido no Brasil. Dessa maneira, ambos os conceitos significam a mesma coisa, apenas muda a nomenclatura.
Vídeos sobre a energia de ionização
Para se aprofundar um pouco mais no assunto e visualizar outros exemplos em que ocorre o processo de ionização, confira a seleção de videoaulas abaixo. As aulas contêm gráficos, diagramas, desenhos e equações que exemplificam o processo.
Energia de ionização: passo a passo
A partir da definição e da tendência periódica do aumento da energia de ionização, o professor conduz a aula comparando a energia do potássio e do lítio. Essa comparação só pode ser feita porque os dois elementos são da família. O professor também aproveita o exemplo do lítio para explicar sobre a energia envolvida na remoção de mais elétrons.
Potencial de ionização e propriedades periódicas
Nessa aula, o conceito de potencial de ionização é apresentado de uma forma bastante visual. O professor usa a tabela periódica para estabelecer relações entre as energias de diferentes elementos, como metais, amentais e os gases nobres. Ele também explica a relação entre o raio atômico e o potencial de ionização. Por fim, o professor conclui a discussão com a associação entre a energia de ionização e as camadas eletrônicas dos átomos.
Variações nas energias de ionização
Com uma explanação sobre a definição do conceito de energia de ionização, os professores se baseiam nos efeitos das forças de atração e de repulsão para justificar a diminuição do raio atômico dos elementos ionizados. Partindo desse princípio, também discutem sobre a variação nas energias de ionização para um mesmo átomo e o seu comportamento na tabela periódica.
Como deu para perceber no decorrer da matéria, a tabela periódica será sua melhor amiga enquanto estiver estudando sobre energia de ionização. Aproveite e confira o conteúdo sobre eletropositivadade, que também está muito relacionado à tabela.
Referências
BROWN, T.L; LEMAY, H.E.; BURSTEN, B.E. Chemistry: the central science. 12 e. Prentice Hall, 2012. p. 260-2.
BURDGE, J.; OVERBY, J. Chemistry: atoms first. 3 e. McGraw Hill, 2018. p. 135-6.
PERUZZO, F.M.; CANTO, E.L. Química na abordagem do cotidiano. vol. 1. 4 ed. São Paulo: Moderna, 2006. p. 128-9.

Por Ademar Vinicius Fagion Freitas
Graduando em Química pela Universidade Estadual de Maringá (UEM), com ênfase na área de ensino. Atua como professor de química no setor privado e como voluntário no Cursinho UEM. Curte ler, assistir filmes e séries nas horas vagas.
Fagion Freitas, Ademar Vinicius. Energia de ionização. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/energia-de-ionizacao. Acesso em: 30 de March de 2025.
1. [UEL-PR]
Em qual das transformações a seguir, no sentido indicado, a energia envolvida mede o chamado “potencial de ionização”?
a) Cl(g) + 1 e– → Cl–(g)
b) 2 Cl(g) → Cl2 (g)
c) H+(aq) + OH–(aq) → H2O(l)
d) Na(g) → Na+(g) + 1 e–
e) H+(aq) + 1 e– → ½ H2 (g)
Resposta: D.
Justificativa: o potencial de ionização está relacionado à formação de íons a partir do átomo neutro em estado gasoso. A adição de energia promove a remoção de um elétron da camada mais externa desse átomo, como consequência, ocorre a formação de um cátion.
2. [UFMG]
As letras W, X, Y e Z designam quatro elementos escolhidos entre aqueles das colunas 1, 2 e 13 da tabela periódica (antigas colunas IA, IIA e IIIA). Seus átomos têm as energias de ionização mostradas na tabela.
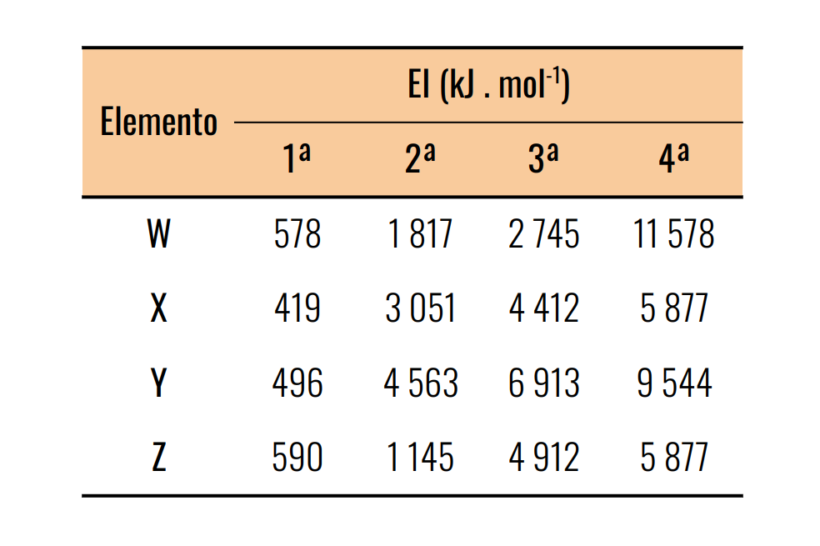
Os valores das sucessivas energias de ionização de um átomo podem dar uma indicação de seu número de elétrons de valência.
Analisando as informações contidas na tabela, conclui-se que a associação correta entre um elemento e a coluna a que ele pertence na tabela periódica é:
a) W – coluna 1 (IA).
b) X – coluna 2 (IIA).
c) Y – coluna 1 (IA).
d) Z – coluna 13 (IIIA).
Resposta: C.
Justificativa: elemento W: o valor da 2ª ionização é um pouco mais que o dobro da 1ª ionização, assim como o valor da 3ª ionização é um pouco menor que o dobro da 2ª ionização. Já o valor da 4ª ionização é um pouco mais que 4 vezes o valor da 3ª ionização. Isso sugere que o átomo desse elemento pode sofrer 3 processos de ionização com certa facilidade, pois os valores de energia não são tão elevados para as 3 primeiras ionizações. Isso sugere que o elemento pertence à coluna 13 (IIIA).
Elemento X: a diferença entre os valores da 1ª e da 2ª ionização é de 2 632 kJ, ou seja, é uma diferença muito grande. Dessa forma, para remover o segundo elétron do átomo desse elemento, é necessária uma quantidade de energia muito grande. Portanto, conclui-se que esse elemento pertence à coluna 1 (IA) da tabela periódica, pois sua tendência é de ter apenas 1 elétron removido.
Elemento Y: como no caso do elemento X, a diferença entre a 1ª e a 2ª ionização é muito grande. Logo, é mais fácil remover apenas o primeiro elétron desse átomo. Portanto, conclui-se que o elemento pertence à coluna 1 (IA).
Elemento Z: da 1ª para a 2ª ionização, a diferença de energia é quase o dobro. Já da 2ª para a 3ª ionização, é de pouco mais de quatro vezes. Dessa forma, pode-se concluir que se trata de um elemento pertence à coluna 2 (IIA), pois 2 de seus elétrons podem ser removidos com certa facilidade.
3. [BROWN et. al., 2012]
A luz pode ser utilizada para ionizar átomos e íons. Qual dos dois processos, representados pelas Equações 1 e 2, necessita de radiação eletromagnética de curto comprimento de onda?
Equação 1: Na(g) → Na+(g) + e
Equação 2: Na+(g) → Na2+(g) + e
Resposta: Equação 2.
Justificativa: a remoção do primeiro elétron requer uma quantidade de energia menor em relação à remoção do 2° elétron. Como a radiação eletromagnética de curto comprimento de onda é mais energética (região do comprimento da luz azul até ultravioleta e de comprimento menor), então, ela pode conter energia suficiente para ionizar uma espécie como o Na+, que já se encontra ionizado, resultando na remoção de um segundo elétron.