A eletrólise permite a realização de reações químicas não-espontâneas pela aplicação de uma corrente elétrica. Esse ramo da eletroquímica pode ser dividido em dois tipos. É aplicada em processos industriais como a confecção de peças metálicas refinadas, para eliminação de ferrugem e em recargas de baterias. Vamos conhecer mais sobre a técnica e seus tipos.
Publicidade
Resumo
A eletrólise é uma área de estudo da eletroquímica que trata de fenômenos físico-químicos para permitir a realização de uma reação de oxirredução não-espontânea a partir da aplicação de uma corrente elétrica contínua e de voltagem suficiente.
Relacionadas
Durante o fenômeno, os íons envolvidos no processo precisam se movimentar para os cátodos ou ânodos, possibilitando o acontecimento da reação química. Sendo assim, para garantir essa liberdade de movimento dos íons, o fenômeno acontece de duas maneiras: por fusão de um sólido iônico (eletrólise ígnea) ou por dissolução (eletrólise aquosa).
Leis da eletrólise
Primeiramente, antes de estudar as divisões da eletrólise, precisamos saber quais são as leis que a regem, em aspectos quantitativos. São duas, ambas formuladas por Michael Faraday, químico e físico inglês.
Primeira lei
A primeira Lei da Eletrólise diz que: “a massa de um elemento, depositada durante o processo de eletrólise, é diretamente proporcional à quantidade de carga elétrica que atravessa a célula eletrolítica”, ou seja, quanto maior for a carga elétrica fornecida para a reação, maior será seu rendimento, em âmbito de material formado. A carga (Q) pode ser calculada por:
m = k1 . Q
Publicidade
- m: massa da substância
- k1: constante de proporcionalidade
- Q: carga elétrica (C)
Segunda lei
Já a segunda lei: “Empregando-se a mesma quantidade de carga elétrica (Q) em diversos eletrólitos, a massa da substância eletrolisada, em qualquer dos eletrodos, é diretamente proporcional ao equivalente-grama da substância”. Ou seja, é possível determinar a quantidade de matéria (mol) de elétrons que participa da reação e a massa da substância formada, como é demonstrado:
m = k2 . E
- m: massa da substância
- k2: constante de proporcionalidade
- E: equivalente-grama
Unindo as equações, chegamos a uma única, responsável pelos cálculos em eletroquímica:
Publicidade
m = K . E . Q
- m: massa da substância
- K: constante de Faraday = 1 / 96500
- E: equivalente-grama
- Q: carga elétrica = intensidade de corrente x tempo (i . t)
Ou seja:
m = (1/96500) . E . i . t
Tipos de eletrólise
O processo de eletrólise pode acontecer pela fusão de um sólido iônico ou pela dissolução de sais em solução aquosa. Vamos ver detalhadamente cada uma delas.
Eletrólise Ígnea
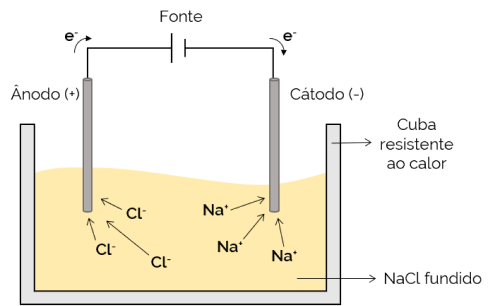
Nesse caso, o eletrólito está fundido (no estado líquido), permitindo, então, que os íons se movimentem pela célula eletrolítica. Um exemplo é a célula de cloreto de sódio (NaCl) que, quando aquecido a cerca 800 °C, se funde. Ao aplicar corrente elétrica na célula, os íons positivos (Na+) são atraídos para o polo negativo (cátodo). Enquanto isso, os íons negativos (Cl– são atraídos para o polo positivo (ânodo). É utilizada no processo de obtenção de metais alcalinos (como o sódio metálico).
Eletrólise Aquosa
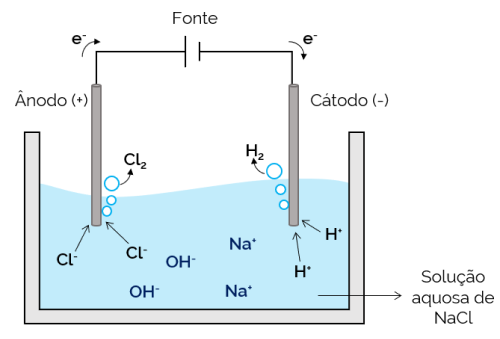
Nesse caso, o eletrólito é uma solução aquosa de íons dissolvidos. Sendo assim, existe, além dos íons do sal, os íons oriundos da dissociação da água (H+ e OH–). Na eletrólise aquosa de cloreto de sódio, os íons H+ e Cl– têm mais facilidade de locomoção quando a corrente é aplicada, quando comparados com os íons Na+ e OH–. Portanto, nos eletrodos, ocorre a formação dos gases H2 e Cl2.
A eletrólise mais comum é a aquosa, por não requerer elevadas temperaturas, que são necessárias para a fusão dos sais iônicos. Porém, isso não descarta o uso da ígnea. Essa, por sua vez é usada em processos industriais para obtenção de metais como sódio ou alumínio.
Aplicações da eletrólise
A eletrólise possui aplicações em diversas áreas da indústria. Vamos, então, ver algumas delas
- Proteção catódica: controla a corrosão de uma estrutura metálica exposta a meios oxidantes como o mar ou até mesmo o ar atmosférico. O recobrimento com outro metal é feiro eletroliticamente
- Obtenção de elementos químicos: síntese de sódio, alumínio, lítio, berílio, entre outros, por eletrólise ígnea.
- Obtenção de gases: síntese de gases como cloro ou hidrogênio por eletrólise aquosa
- Purificação de metais: cobre pode ser purificado em uma célula eletrolítica.
- Galvanização: consiste na eletrodeposição de metais como cromo, níquel, cobre, zinco ou outros. Utilizado para criação de uma camada protetora para uma peça.
É uma técnica muito útil na indústria, principalmente na de metais. Sem a camada protetora oferecida pela deposição eletroquímica, objetos se deteriorariam muito rapidamente. No caso de estruturas de edifícios ou pontes, isso seria extremamente perigoso para a segurança da população. Sendo assim, a eletrólise é essencial.
Vídeos sobre a eletrólise
Agora, vamos ver vídeos que nos ajudam a assimilar o conteúdo estudado
Quais os tipos de eletrólise que existem
A eletrólise é um processo eletroquímico que está muito presente na indústria química e de metais. Pode ser dividida em duas categorias, conforme o modo que é realizada. Confira quais são essas categorias e tire todas as suas dúvidas sobre o assunto.
A eletrólise ao nosso favor
Você sabia que é possível recuperar peças de metal que estão enferrujadas? Isso pode ser feito com a eletrólise aquosa. Nesse vídeo vemos um exemplo desse fenômeno e a ferrugem dos objetos metálicos recupera seu brilho característico.
Como ocorre o processo eletrolítico ígneo
A eletrólise ígnea é menos comum, se comparada com a aquosa, afinal elevadas temperaturas são necessárias para fundir o sal iônico, fazendo com que seja um processo realizado somente em ambiente controlado. Essa animação nos ajuda a entender como que se dá o processo de eletrólise de NaCl fundido.
Por fim, a eletrólise é uma técnica que permite a realização de reações não-espontâneas por meio da aplicação de uma corrente elétrica na célula eletrolítica. Nela, ocorre uma reação de oxidação-redução das espécies envolvidas. Saiba mais sobre as reações de oxirredução, importantes para o entendimento da célula eletroquímica.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Físico-Química (1986) – Gilbert Castellan
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Eletrólise. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/eletrolise. Acesso em: 04 de April de 2025.
1. [FEI-SP]
O alumínio é obtido industrialmente pela eletrólise ígnea da alumina (Al2O3). Indique a alternativa falsa:
a) O íon alumínio sofre redução.
b) O gás oxigênio é liberado no ânodo.
c) O alumínio é produzido no cátodo.
d) O metal alumínio é agente oxidante.
e) O íon O2- sofre oxidação.
A reação de eletrólise da alumina, bem como as semi-reações das espécies, é:
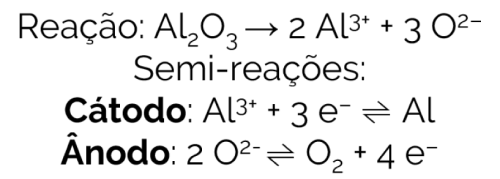
Explicando as alternativas:
a) Pela semi-reação do cátodo, percebemos que o alumínio passa de +3 para 0, ou seja, sofre redução.
b) Na semi-reação do ânodo, vemos a liberação de um mol de O2, gás óxigênio.
c) O mesmo é observado na primeira semi-reação. Alumínio se forma no cátodo.
d) O íon Al3+ sofreu redução, portanto ele é o agente oxidante e não o alumínio metálico.
e) O íon O2- passa de -2 para 0, oxidou.
2. [UFRGS-RS]
No cátodo de uma célula de eletrólise sempre ocorre:
a) Deposição de metais.
b) Uma semi-reação de redução.
c) Produção de corrente elétrica.
d) Desprendimento de gás hidrogênio.
e) Corrosão química.
Alternativa correta é a letra B. No cátodo é de onde os cátions se desprenderam, sendo assim, há um ganho de elétrons nessa região. Consequentemente uma redução acontece.
O cátodo é assim chamado porque ele é o polo onde se desprendem os cátions; portanto, onde há ganho de elétrons, há redução.