“Em sua forma líquida é comumente chamada de solvente universal (muitas substâncias conhecidas nela se dissolve) como também o líquido mais abundante da face da Terra. Está em equilíbrio dinâmico entre os estados sólido (geleiras e calotas polares), gasoso (ar, nuvens) e líquido (rios, lagos, chuva).” (ESTEVES, 1998)
Publicidade
Densidade é uma grandeza específica de cada material. É dada pela razão entre a massa e o volume do corpo, medindo assim o grau de concentração de massa em dado volume:
![]()
A água em seu estado líquido em temperatura ambiente (20°C) apresenta uma densidade próxima de 0,99 g/cm3. Diminuindo sua temperatura, a água atinge um valor máximo de densidade próximo a temperatura de 4°C, com um valor de 1,00g/cm3. No entanto, a temperaturas menores que 0°C, sua densidade diminui para valores próximos de 0,91g/cm3, tornando assim possível a água sólida flutuar sobre a água líquida.
Um fator que contribui para o comportamento singular da água é sua estrutura molecular. A água possui a fórmula molecular H2O, tendo um átomo de Oxigênio ligado a dois átomos de Hidrogênio.
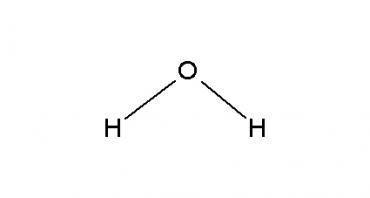
Pela figura acima, percebemos que a molécula de água possui uma geometria angular e com hidrogênios ligados diretamente ao átomo de Oxigênio por meio de ligação covalente. Ao adicionar outra molécula de H2O, haverá uma interação entre essas duas moléculas, interação esta chamada de Ligação de Hidrogênio, um tipo de interação muito forte devido à polaridade da molécula da água: o átomo de Oxigênio atrai para si os elétrons dos átomos de Hidrogênio da ligação, adquirindo assim uma carga parcialmente negativa, enquanto os átomos de Hidrogênio ficam com uma carga parcialmente positiva. Desse modo, a molécula de H2O fica polarizada, do lado do Oxigênio com carga negativa e do lado do Hidrogênio com carga positiva. Duas moléculas de água polarizadas resultam numa atração similar à eletrostática, mas nesse caso envolve a diferença de cargas parciais entre moléculas de Hidrogênio e de Oxigênio.
A termodinâmica define temperatura como o grau de agitação das moléculas. Com base nessa definição, se um corpo estiver com alto grau de agitação, terá uma maior temperatura; caso contrário, uma menor temperatura. Conforme o esfriamento da água, suas moléculas constituintes vão se empacotando cada vez mais, garantindo assim uma maior densidade, pois o volume de moléculas é menor. Em água líquida, as moléculas estão mais afastadas, e quanto mais se aquece a água até sua fervura (ou ebulição), as moléculas tendem a se afastar mais ainda para passar ao estado gasoso. Por essa razão a água sólida na presença de água líquida flutua. Este fenômeno pode ser observado desde um copo de água com gelo até os icebergs nos oceanos.
Publicidade

Outro efeito direto relacionado à densidade da água é o fenômeno de estratificação de um corpo de água (rio, lago, lagoa). Para que a vida aquática seja equilibrada em um corpo de água, é preciso haver nutrientes para os seres que lá habitam.
Dessa forma, ocorre o fenômeno de estratificação térmica, onde são formadas camadas de diferentes temperaturas. Quanto mais profundo o corpo de água, mais densa é a camada de estratificação ocasionando assim menor temperatura. Assim, perto da superfície a temperatura da água é em torno de 20°C, que diminui ao aumentar a profundidade. Por essa razão, em regiões muito frias durante o inverno é formada uma camada de gelo sobre o corpo de água rente a superfície enquanto na parte de dentro é possível encontrar água líquida. O gelo é um excelente isolante térmico, com a formação de uma camada de gelo na superfície de um lago, a temperatura da água no interior se mantém de modo a conservar a vida aquática.
Publicidade
Referências
ESTEVES, F. Fundamentos de Limnologia. Rio de Janeiro: Interciência/FINEP, 1998.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Densidade da água. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/densidade-da-agua. Acesso em: 29 de December de 2025.
1. [UFMG] Em um frasco de vidro transparente, um estudante colocou 500 mL de água e, sobre ela, escorreu vagarosamente, pelas paredes internas do recipiente, 50 mL de etanol. Em seguida, ele gotejou óleo vegetal sobre esse sistema. As gotículas formadas posicionaram-se na região interfacial, conforme mostrado nesta figura:
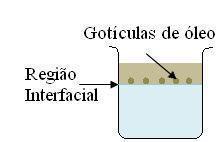
Considerando-se esse experimento, é correto afirmar que:
a) A densidade do óleo é menor que a da água.
b) A massa da água, no sistema, é 10 vezes maior que a de etanol.
c) A densidade do etanol é maior que a do óleo.
d) A densidade da água é menor que a do etanol.
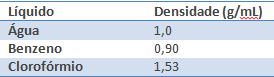
2. [UEL/2008] Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta originando o seguinte aspecto:

A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.
1. [A]
Analisando a figura vemos a posição das gotículas de óleo que foram adicionadas. Não afundaram, ficaram junto à superfície, evidenciando assim uma menor densidade em relação à água.
2.
Sabemos que uma substância mais densa tende a ter maior concentração de massa em determinado volume, sendo assim, em líquidos o mais denso tende a ir para a parte inferior do recipiente enquanto o menos denso na parte superior. Pela tabela do enunciado, temos que o líquido menos denso é o benzeno, este, portanto deve estar na parte mais superior, representada pela letra A. O líquido mais denso dentre os da tabela é o clorofórmio, que deve ficar na parte mais inferior, representada pela letra C. A densidade da água está em um valor intermediário entre os extremos, ficando assim na parte representada pela letra B.