O chumbo é um elemento da tabela periódica, com símbolo Pb e número atômico de 82. É um metal pesado mais denso que a maioria dos outros materiais comuns. Além disso, é macio e maleável, com um ponto de fusão relativamente baixo. É altamente tóxico para os seres humanos. Aprenda mais sobre a história e propriedades desse elemento químico.
Publicidade
História
A origem da palavra “chumbo” é do latim plumbum, explicando o fato de seu símbolo ser Pb. A hipótese proposta por pesquisadores é de que a fundição do metal começou há 9000 anos e o artefato de chumbo mais antigo já encontrado é uma estatueta egípcia, datada em cerca de 3800 a.C. No Império Romano, um composto desse elemento, o acetato de chumbo, era usado como adoçante. Porém, assim como todo derivado de chumbo, era altamente tóxico, o que causou diversos problemas em muitas pessoas na época.
Relacionadas
Em sua forma elementar, ou seja, como um metal puro, o chumbo é raramente encontrado na natureza. Portanto, quando extraído, está na sua forma mineral, como a galena (PbS), anglesita (PbSO4) e cerusita (PbCO3). Sendo assim, uma de suas formas de obtenção é pela extração e refino dos minérios citados. Além disso, é possivel obter o metal pela desintegração radioativa dos radioisótopos urânio e tório.
Propriedades do chumbo
O chumbo pertence ao grupo 14 da tabela periódica, ou seja, é do grupo do carbono, possuindo o subnível p como o mais energético. Além disso, ele possui outras características, tais como as citadas a seguir.
- Seu ponto de fusão é um dos menores entre todos os metais, sendo de 327,46 °C, ou seja, é um sólido em temperatura ambiente;
- Tem temperatura de ebulição de 1748,85°C, o menor de todos os metais;
- Sua densidade é de 11,34 g/cm3 à temperatura ambiente, aproximadamente 10 vezes maior que a da água;
- É um metal de baixa dureza, isso significa que é facilmente maleável e dúctil;
- Tem alta resistência à corrosão;
- Possui 7 estados de oxidação (-4, -2, -1, +1, +2, +3 e +4), porém os principais são apenas 2 (+2 e +4), visto que a maioria dos compostos de chumbo são quando o elemento é divalente ou tetravalente;
- Sua configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d10 6s2 6p2, portanto é um metal representativo da família do carbono, com quatro elétrons de valência;
- É um péssimo condutor elétrico;
- É considerado um elemento anfótero, ou seja, que pode reagir com ácidos ou com bases, tendendo a formar ligações covalentes
Além disso, o chumbo tem tendência de formar compostos com todos os halogênios (flúor, cloro, bromo e iodo), que possuem fórmula de PbX2, em que X representa o halogênio. Ainda, o chumbo é um elemento tóxico. Saiba mais sobre isso a seguir.
O que o chumbo causa à saúde
O principal sistema do organismo afetado pela intoxicação de chumbo é o sistema nervoso, visto que pode causar diversos problemas, como dificuldade de concentração e memorização, tontura, dores de cabeça e outras encefalopatias (doenças cerebrais). Além disso, o sangue contaminado com o elemento prejudica o funcionamento dos rins, na síntese de hemoglobinas. Seja como for, é um elemento muito tóxico e que pode causar a morte.
Publicidade
Usos do chumbo
Hoje em dia, a principal forma de utilização do chumbo, é em sua forma metálica (elementar), ou seja, como Pb0. Veja algumas dessas aplicações.
- Baterias de automóveis: as baterias de chumbo-ácido sulfúrico são as mais comuns hoje em dia, visto que têm boa autonomia para manter o funcionamento de veículos como carros e motos. Elas são constituídas de eletrodos de chumbo, em diferentes formas, além de uma solução de ácido sulfúrico;
- Em equipamentos de raios-X e gama: o metal é resistente à radiação de alta energia, como é o caso dos raios-x e a radiação gama. Por isso, ele é usado como manta protetora de equipamentos que trabalham com essa energia;
- Recipiente para descarte de dejeto radioativo: pelo mesmo motivo anterior, caixas de chumbo são construídas para manter seguras as áreas próximas de materiais radioativos;
- Tubulação: é empregado na construção civil, nas tubulações, por conta de sua resistência à corrosão;
- Ligas metálicas: chumbo é misturado com outros elementos para formação de ligas metálicas. Exemplos desses são estanho, cobre, arsênio, antimônio, bismuto, cádmio e sódio.
Além dessas, o chumbo em sua forma molecular, ou seja, como composto, é usado em outras aplicações como a formação de vidro de chumbo, em que um sal desse elemento (PbO) é usado de aditivo na produção de vidro, produzindo um cristal de propriedades ópticas diferentes do cristal comum.
Vídeos sobre o chumbo
Agora que o conteúdo foi apresentado, veja alguns vídeos selecionados para ajudar a assimilar o tema do estudo.
Publicidade
Características e aplicações do elemento de número atômico 82
O chumbo, Pb, é um elemento químico da tabela periódica, com número atômico 82 e massa atômica de 307 u. Sua forma metálica é de um sólido cinza e denso, porém é bastante maleável e possui um dos menores pontos de fusão entre todos os metais. Aprenda mais sobre as propriedades e características desse elemento, bem como algumas de suas principais aplicações.
Experiência com os compostos de chumbo
Muitos compostos inorgânicos formados a partir do chumbo são coloridos, principalmente quando esse elemento está associado aos elementos da classe dos halogênios, como é o caso do iodeto de chumbo. Para obter esse composto, é feita uma reação de dupla troca entre os íons dos sais: iodeto de potássio e nitrato de chumbo. Veja essa reação acontecer e observe como a recristalização do novo composto tem um efeito de chuva de gliter no balão de fundo chato. Veja, também o efeito Tyndall acontecendo quando o feixe de laser verde é incidido na solução.
O adoçante tóxico da antiguidade
Por muito tempo, até se ter noção completa dos efeitos tóxicos que os compostos de chumbo possuem, o acetato de chumbo (Pb(OAc)2) era usado como adoçante. Isso foi há muito tempo, antes mesmo da descoberta da sacarose, usada até hoje e presente no açúcar de mesa. O Pb(OAc)2 era símbolo de riqueza e foi usado durante a época do Império Romano. Saiba mais sobre a história desse adoçante que causa inúmeros danos ao organismo, principalmente ao sistema nervoso central.
Em síntese, o chumbo é um elemento da tabela periódica que possui uma forma metálica muito estável e utilizada em diversas finalidades por conta de suas propriedades. É, ainda, muito tóxico para o organismo humano, podendo causar a morte depois de uma exposição prolongada e excessiva. Não pare de estudar por aqui, aprenda sobre outro metal, o cobre.
Referências
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge.
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch.
The Elements – A Visual Exploration of Every Known Atom in the Universe. (2009) Theodore Gray.
The History of Lead by Christopher Winder (On-line) – Disponível em: https://lead.org.au/lanv2n3/lanv2n3-22.html. Acesso em : 04 de nov. de 2021.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Chumbo. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/chumbo. Acesso em: 02 de April de 2025.
1. [UNB-DF (adaptada)]
A bateria de automóveis possui dois tipos de eletrodos (de PbO e de Pb0), mantidos em solução aquosa de ácido sulfúrico, H2SO4(aq). A equação correspondente à reação envolvida na geração de energia é:
PbO2 + Pb0 + 2 H2SO4 → 2 PbSO4 + 2 H2O
Qual das afirmativas abaixo está errada?
1 – Nos eletrodos de PbO2 ocorre oxidação.
2 – O elemento chumbo sofre oxidação nos eletrodos de Pb0 e redução nos eletrodos de PbO2.
3 – O estado de oxidação do chumbo no PbO2 é +4.
4 – Nos eletrodos de Pb0 há perda de elétrons.
Os números de oxidação das espécies envolvidas na reação é mostrado abaixo. Saber disso é importante para a interpretação das afirmativas.
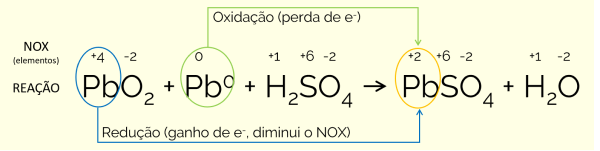
Dessa forma, a afirmativa que está errada é a de número 1, pois o eletrodo de PbO2 sofre redução, visto que na reação ele se torna PbSO4 pelo ganho de 2 elétrons. O NOX do Pb passa de +4 para +2. As demais afirmativas estão corretas porque:
2 – No eletrodo de Pb0, o elemento passa a ter NOX = +2, ou seja, oxida pela perda de elétrons. Já no outro eletrodo, de PbO2, ocorre uma redução, como já apontado anteriormente.
3 – Esse é o valor do NOX do chumbo nesse composto.
4 – Ocorre a perda de elétrons no eletrodo de chumbo metálico e ele passa de um NOX menor (0) para um maior (+2).
2. [UFU-MG]
A solubilidade do sulfato de chumbo II (PbSO4) em água a 18 °C é de 0,041 g/L. A constante do produto de solubilidade do sulfato de chumbo a 18 °C é:
Dados: S = 32 g/mol; O = 16 g/mol; Pb = 207 g/mol.
a) 1,8 × 10-8
b) 2,4 × 10-5
c) 4,5 × 10-4
d) 5,5 × 10-7
e) 5,5 × 107
A questão procura descobrir qual é a constante do produto de solubilidade (Kps) do sulfato de chumbo. Para isso é necessário saber as concentrações dos íons produzidos pela solubilização desse composto em meio aquoso, representado pela equação:
PbSO4 → 1 Pb+2 + 1 SO4-2
A equação para o cálculo do Kps é dada por:
KpsPbSO4 = [Pb+2].[SO4-2]
Em que [Xn] indica a concentração do determinado íon Xn.
Dessa forma, para calcular o Kps é preciso saber qual é a concentração de cada íon em solução. Isso é feito pela solubilidade do sal em água, na temperatura de 18 °C, que é de 0,041 g/L.
A solubilidade (S), nesse caso, é expressa em grama por litro (g/L). Porém, a concentração molar (C) precisa ser expressa em mol/L. A conversão é feita da seguinte maneira.
Sabendo a massa molar (MM) do composto:
PbSO4 = 1 x 207 + 1 x 32 + 4 x 16 = 207 + 32 + 64 = 303 g/mol
C = S / MM
C = 0,041 / 303
C = 1,35 x 10-4 mol/L
A dissolução de um mol de sulfato de chumbo em solução forma um mol de Pb+2 e um mol de SO4-2, por conta da estequiometria da reação. Sendo assim, a concentração de chumbo (II) é igual a concentração de sulfato, e elas são iguais à 1,35 x 10-4 mol/L:
[Pb+2] = [SO4-2] = 1,35 x 10-4 mol/L
Substituindo tudo isso na equação do Kps:
KpsPbSO4 = [Pb+2].[Pb+2]
KpsPbSO4 = [Pb+2]2
KpsPbSO4 = (1,35 x 10-4)2
KpsPbSO4 = 1,83 x 10-8
Portanto a alternativa correta é a letra a) 1,8 × 10-8.