Carbono quiral é aquele que possui quatro ligantes diferentes, sejam eles átomos, radicais ou grupos funcionais. Uma molécula é considerada quiral quando pelo menos um de seus carbonos for quiral, e se ela não se sobrepor com a sua forma espelhada. Entenda melhor sobre essa propriedade de compostos orgânicos muito utilizada na indústria farmacêutica.
Publicidade
O que é o carbono quiral
O carbono quiral consiste em um átomo de carbono sp3, ou seja, aquele que realiza somente ligações simples e que possui quatro grupos ligantes diferentes. A quiralidade é um termo utilizado em química orgânica para designar moléculas que não se sobrepõem em suas imagens espelhadas.
Relacionadas
Ele também é conhecido como carbono assimétrico, visto que uma molécula quiral não possui simetria de suas imagens espelhadas. Para representação de um carbono assimétrico, é comum utilizar o C* no meio de uma cadeia carbônica, que indica o átomo que faz as 4 ligações com grupos diferentes.
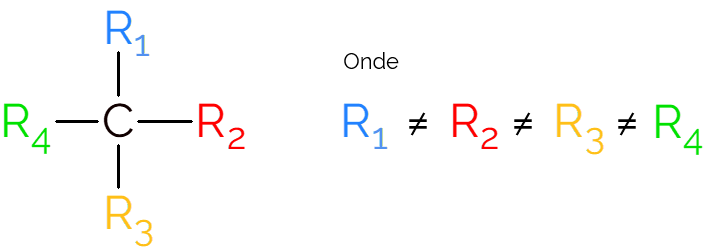
Nas representações do carbono quiral é comum encontrar a fórmula como na imagem acima, com uma ligação em cada direção. Porém, é preciso lembrar que esse C tem hibridização sp3, portanto tem geometria tetraédrica. Veja, a seguir como identificar um carbono assimétrico.
Como identificar
Para fazer a identificação de um carbono quiral, primeiramente é preciso escrever a estrutura molecular da molécula em estudo, pois assim fica mais fácil de observar quais átomos de carbono fazem ligações com quatro grupos diferentes. Aqueles carbonos que possuírem dois ou mais átomos de hidrogênio devem ser desconsiderados, visto que não são quirais. Além disso, o C* nunca ocorre quando há dupla ligação, pois C desse tipo é sp2.
Carbono quiral em cadeia aberta
Em cadeia carbônica aberta, é mais fácil de encontrar um carbono quiral. Uma regra prática é a de que sempre que um carbono tiver 3 ramificações, ele pode ser um candidato a ser quiral. No exemplo a seguir se encontra a molécula do ácido lático, que apresenta quiralidade no C2: de um lado ele se liga à metila, do outro ao grupo carboxílico, acima à hidroxila e abaixo ao hidrogênio.
Publicidade
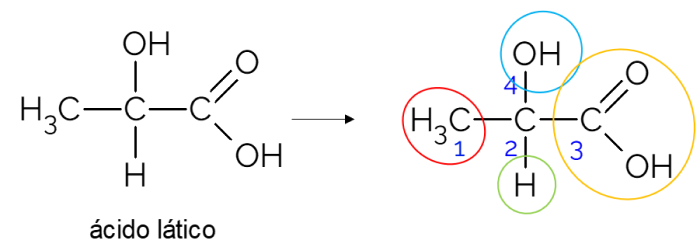
Carbono quiral em cadeia fechada
Em cadeias fechadas também é possível encontrar carbonos quirais. Quando há apenas um anel, independente do número de carbonos que possua, o C* somente está presente se existirem ramificações nesse anel. Um exemplo é dado a seguir, da molécula de 3-propil-ciclopentanona: o C3 está ligado com o hidrogênio, com o propil e no ciclo, onde a parte superior (CH2C=O) difere da inferior (CH2CH2).
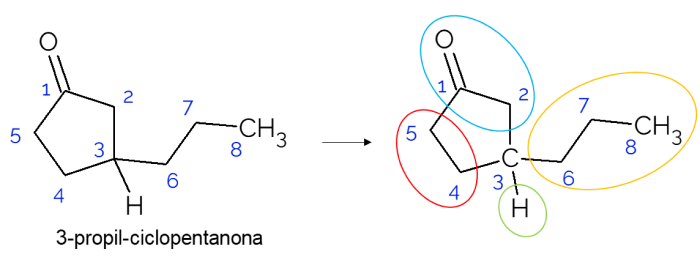
Em moléculas maiores, é mais comum encontrar carbonos quirais, por conta da complexidade de sua estrutura molecular. Geralmente, os fármacos são substâncias em que a quiralidade é de extrema relevância, visto que a substância pode não ter o mesmo efeito conforme sua isomeria. A seguir, entenda mais sobre essa importância.
A importância do carbono quiral
Quando uma molécula é quiral, ela possui isomeria óptica. Isso significa que os dois compostos são chamados de enantiômeros. Eles possuem as mesmas características físicas, como ponto de fusão ou ebulição, porém se diferem em relação ao desvio de luz polarizada e o modo de interação com sistemas biológicos. Esse segundo fato é o mais importante.
Publicidade
Por conta dessa característica, fármacos constituídos de moléculas que possuem centros quirais podem ter um enantiômero que cumpre o papel do remédio e outro que pode causar danos ao organismo. É o caso da talidomida, que era um medicamento utilizado para tratar enjoos de grávidas, na década de 1950. Mas o que não se sabia é que, enquanto um dos enantiômeros dessa molécula era eficiente, o outro, era teratogênico, ou seja, causava má formação dos fetos. Por conta disso, o uso do medicamento foi suspenso.
Desde então, a ciência de produção de medicamentos é rigorosa quanto a formação de moléculas com centros assimétricos, em que cada enantiômero formado dos medicamentos são testados, para que não ocorra casos como o da talidomida.
Vídeos sobre carbono quiral
Agora que o conteúdo foi apresentado, veja alguns vídeos que te ajudarão a assimilar o tema estudado.
Carbono quiral e isomeria óptica
As moléculas quirais possuem imagens especulares não sobreponíveis, assim como nossas mãos. Ocorrem quando algum carbono de uma molécula realiza quatro ligações com grupos diferentes. Saiba tudo sobre a isomeria ótica formada em moléculas assimétricas, veja exemplos e saiba identificar um C*.
Exemplos para determinar carbonos assimétricos
Para dominar a técnica de determinação da quiralidade de moléculas, nada melhor que praticar bastante. Veja exemplos de moléculas quirais e aprenda, definitivamente, como fazer essa determinação.
Como identificar um carbono quiral
Carbonos com hibridização sp3, ou seja, com geometria tetraédrica e que fazem 4 ligações simples, podem ser quirais, desde que essas quatro ligações sejam com grupos distintos. Saiba como encontrar e determinar o carbono quiral de moléculas orgânicas de cadeias abertas e fechadas.
Em síntese, um carbono quiral é aquele que realiza quatro ligações com ligantes diferentes. As moléculas assimétricas possuem isomeria óptica e os enantiômeros formados podem interagir de maneiras diferentes com sistemas biológicos. Não pare de estudar aqui, aprenda mais sobre as cadeias carbônicas.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Orgânica (1976) – T. W. Graham Solomons
Química Orgânica – Volume 1 (1987) – Paula Yurkanis Bruice

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Carbono quiral. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/carbono-quiral. Acesso em: 02 de April de 2025.
1. [UDESC 2008 - Adaptada]
A 3,4-metilenodioximetanfetamina (MDMA) foi sintetizada na Alemanha, em 1914, e utilizada como moderador de apetite. Na década de 70, essa droga passou a ter fins psicoterápicos, mas seu uso se tornou abusivo, provocando lesões nos neurônios e, com isso, ela passou a ser proibida.
Muito comum no meio dos adolescentes, ela é conhecida como ecstasy, XTC, Adam e Droga do amor. Ela pode ser classificada como um psicoestimulante, semelhante às anfetaminas e à cocaína, como também ser agrupada com os alucinógenos, devido às alucinações e flashbacks, se usada em doses muito altas.
A fórmula estrutural 3,4-metilenodioximetanfetamina encontra-se representada na abaixo:
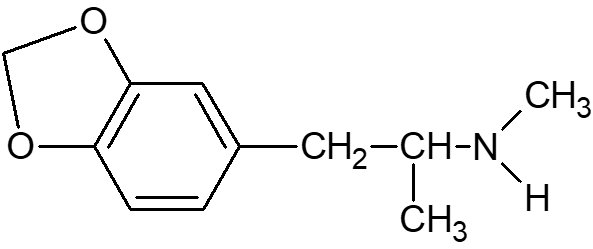
Determine o número de carbonos assimétricos presentes na fórmula estrutural da MDMA.
a) Encontram-se três carbonos assimétricos.
b) Encontram-se dois carbonos assimétricos.
c) Encontra-se apenas um carbono assimétrico.
d) Encontram-se onze carbonos assimétricos.
e)Não existem carbonos assimétricos na fórmula da 3,4-metilenodioximetanfetamina.
A molécula da MDMA possui 11 carbonos, como pode ser visto:
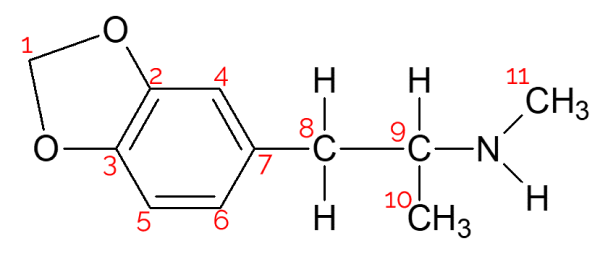
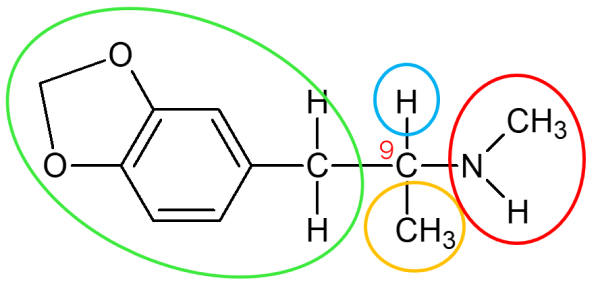
Desses, apenas um possui 4 substituintes diferentes, que é o carbono 9. Ele está ligado ao hidrogênio (acima), ligado à direita ao grupo do nitrogênio, abaixo à metila, e à esquerda ao restante da cadeia carbônica. Portanto a alternativa correta é a letra c) Encontra-se apenas um carbono assimétrico.
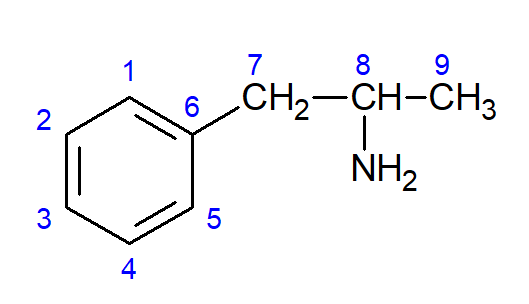
2. [Unifor – CE]
A molécula de anfetamina apresenta isomeria óptica, possuindo, portanto, um carbono com quatro diferentes substituintes. Na anfetamina, esse átomo de carbono está representado pelo:
a) C1
b) C6
c) C7
d) C8
e) C9
Das alternativas, somente o carbono 8 é o que possui quatro substituintes diferentes, sendo eles:CH3, H, NH2 e CH2 ─ Anel aromático. No caso das demais alternativas, pelo menos dois substituintes são iguais: No C1 e C7 existem 2 H. O C6 possui os ligantes C1 e C5, que são iguais; e o C9 tem 3 H ligados a ele.