Uma das leis da física que está presente em nosso dia-a-dia, desde o funcionamento da geladeira até o estouro de uma garrafa de champagne: a Primeira Lei da Termodinâmica. Essa lei distingue as trocas de energia na forma de calor e trabalho e os relaciona com uma grandeza que está ligada com o estado do sistema físico – a energia interna.
Publicidade
O que é a Primeira Lei da Termodinâmica
A Primeira Lei da Termodinâmica pode ser entendida como uma extensão do Princípio da Conservação de Energia. Porém, ela amplia esse postulado físico para compreender as transferências de energia por meio das trocas de calor e pela realização de trabalho. Essa lei também nos apresenta o conceito de energia interna, o qual está diretamente ligado à temperatura do corpo.
Relacionadas
Fórmulas e aplicações da 1ª Lei da Termodinâmica
Já imaginou o que a geladeira, o carro e o ar-condicionado têm em comum? Todos eles usufruem dos princípios da Primeira Lei da Termodinâmica. Essa lei postula que:
A variação da energia interna em um corpo é expressa pela diferença entre a quantidade de calor trocada por um corpo e o trabalho realizado durante a transformação termodinâmica.
Matematicamente:
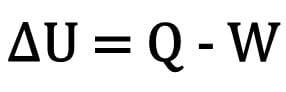
Publicidade
Onde:
- ?U: variação da energia interna;
- Q: quantidade de calor;
- W: trabalho realizado durante a transformação.
Note que todas as grandezas físicas envolvidas na Primeira Lei da Termodinâmica são referentes a energia ou calor (que também é uma forma de energia). Dessa forma, em unidades do Sistema Internacional (SI), todas as grandezas devem estar em Joules (J). Usualmente, tais grandezas podem ser denotadas em unidades de calorias (cal). Onde 1 cal = 4,2 J.
Além disso, em alguns lugares, é comum apresentar o trabalho realizado pelo sistema durante a transformação termodinâmica (W) pela letra grega tau (?). Porém, não existem diferenças no significado físico caso uma notação diferente seja escolhida.
Publicidade
Casos especiais
Existem quatro tipos de processos termodinâmicos específicos que são muito frequentes em situações práticas. São eles: processo adiabático, processo isocórico (ou isovolumétrico), processo isobárico e processo isotérmico. Abaixo veremos do que se trata cada um.
- Processo adiabático: nesse processo não ocorre nenhuma transferência de calor no sistema, ou seja, Q = 0. Se analisarmos a fórmula da Primeira Lei da Termodinâmica, é possível observar que, em qualquer processo adiabático ?U = – W. Caso o sistema se expanda adiabaticamente, o trabalho realizado é positivo e a energia interna diminui. Caso o sistema se comprima adiabaticamente, o trabalho realizado é negativo e a energia interna aumenta. Um exemplo de processo adiabático é quando a rolha de uma garrafa de champagne estoura. A expansão dos gases acontece tão rápido que não há tempo para trocas de calor com o ambiente.
- Processo isocórico (ou processo isovolumétrico): nesse processo o volume do sistema termodinâmico permanece constante. Caso o volume de um sistema termodinâmico seja constante, ele não realizará trabalho. Ou seja, W = 0. Analisando a fórmula da Primeira Lei da Termodinâmica, é possível observar que no processo isovolumétrico ?U = W. Em um processo isocórico todo o calor permanece no interior do sistema, o que contribui para o aumento da energia interna. Um exemplo de processo isocórico é a explosão de latas de aerossol devido ao aquecimento. O volume dentro do recipiente permaneceu constante, porém, sua energia interna aumentou devido às trocas de calor.
- Processo isobárico: no processo citado, a pressão sobre o sistema termodinâmico é constante. Dessa forma, nenhuma das grandezas envolvidas na transformação (energia interna, calor e trabalho) será nula. Um exemplo de processo isobárico é a fervura da água dentro de uma panela à pressão constante.
- Processo isotérmico: nesse processo, como você já deve imaginar, a temperatura será constante. Para que isso ocorra, a transferência de calor deve ser suficientemente lenta. Um exemplo de transformação isotérmica é um gás ideal. Tal sistema é um caso especial que a energia interna dependa apenas da temperatura e não do volume ou da pressão. Nesses casos a energia interna é constante, isso implica que ?U = 0. Consequentemente, o calor trocado será numericamente igual ao trabalho realizado pelo sistema (Q = W).
Como vimos, a Primeira Lei da Termodinâmica é muito presente em nosso dia a dia. Seja durante a fervura de uma panela com água até mesmo no ar-condicionado de nossa casa! Que tal saber mais sobre esse conceito físico vendo os vídeos abaixo?
Vídeos sobre a Primeira Lei da Termodinâmica
Para que não haja dúvidas e para aprofundar os seus conhecimentos, indicamos alguns vídeos em relação ao conteúdo que estudamos até aqui.
Primeira Lei da Termodinâmica
Aprofunde e pratique seus conhecimentos acerca da Primeira Lei da Termodinâmica com esse vídeo explicativo.
Experimento sobre uma transformação isovolumétrica
Veja um exemplo experimental de uma transformação isovolumétrica e não tenha mais dúvidas sobre esse assunto.
Aprofundamento na Primeira Lei da Termodinâmica
Que tal aprofundar ainda mais os conhecimentos sobre a Primeira Lei da Termodinâmica? Confira o vídeo e bons estudos!
Outro tópico importante de termodinâmica é o Ciclo de Carnot. Leia mais sobre ele e fique por dentro da matéria.
Referências
YOUNG, Hugh D. et al. Física II: Termodinâmica e Ondas. São Paulo: Addison Wesley, 2008.

Por Hugo Shigueo Tanaka
Divulgador Científico e co-fundador do canal do YouTube Ciência em Si. Historiador da Ciência. Professor de Física e Matemática. Licenciado em Física pela Universidade Estadual de Maringá (UEM). Mestre em Ensino de Ciências e Matemática (PCM-UEM). Doutorando em Ensino de Ciências e Matemática (PCM-UEM).
Tanaka, Hugo Shigueo. Primeira Lei da Termodinâmica. Todo Estudo. Disponível em: https://www.todoestudo.com.br/fisica/primeira-lei-da-termodinamica. Acesso em: 02 de April de 2025.
1. [URCA]
De acordo com a primeira lei da termodinâmica se, durante um processo isotérmico sofrido por um gás ideal de massa fixa, o gás libera uma quantidade de calor cujo módulo é de 50 cal então a variação de energia interna e o trabalho realizado pelo gás neste processo são, respectivamente:
a) 0 cal e 50 cal
b) 50 cal e 0 cal
c) 0 cal e 0 cal
d) 50 cal e -50 cal
e) 50 cal e 50 cal
RESOLUÇÃO: Como se trata de uma transformação isotérmica de um gás ideal, temos que ?U = 0 e, então, Q = -W.
Além disso, o gás libera 50 cal de calor, assim, Q = -50 cal. Dessa forma, W = -50 cal. A resposta correta é a letra E: ?U = 0 e W = -50 cal.
2.
Calcule a variação da energia interna de um sistema que recebe 300 J de calor e realiza um trabalho de 50 J. É possível afirmar se esse sistema está se expandindo ou se comprimindo? Justifique sua resposta.
Coletando os dados do exercício temos que:
Q = 300 J
W = 50 J
Como desejamos descobrir a variação da energia interna, basta substituir os valores na equação da Primeira Lei da Termodinâmica: ?U = Q – W.
Assim:
?U = 300 J- 50 J
?U = 250 J
Além disso, o sistema está se expandindo porque W>0.