O equilíbrio térmico, igualmente denominado como equilíbrio termodinâmico, retrata quando dois corpos atingem uma mesma temperatura. O conceito está diretamente relacionado ao compartilhamento de calor e temperatura.
Publicidade
Assim, dois corpos irão transferir calor de forma espontânea, em meio ao contato entre eles, até que atinja-se o equilíbrio. No processo de equilíbrio térmico, o corpo mais quente transferirá calor para o mais frio até atingirem a mesma temperatura.
O equilíbrio térmico ocorre a partir de uma troca de energia entre ambos os corpos que interagem. Denominada como energia calorífica, ela resulta da perda desta energia pelo corpo mais quente, que a transfere ao corpo mais frio.
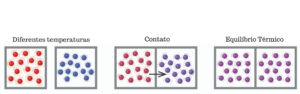
Exemplo de equilíbrio térmico
O melhor exemplo para especificar o equilíbrio térmico é com líquidos. Ao misturar um líquido quente com um frio, temos uma troca de energias que envolvem a mistura.
Mais prático, peguemos o café com leite como exemplo. Um café escaldante em contato com um leite frio.
Supondo que ambos apresentem temperaturas iniciais bastante distintas. Enquanto o café apresentará 60ºC, o leite, que estava na geladeira, apresenta 10ºC.
A mistura, ao entrar em contato, tenderá a ficar morna. Isso se deve ao fato de o café (quente) transmitir energia calorífica ao leite (corpo frio).
Publicidade
Como ambos tinham específicas temperaturas (60ºC e 10ºC), o equilíbrio térmico será alcançado quando a mistura apresentar 35ºC.
Fórmula para o cálculo do equilíbrio térmico
O equilíbrio térmico é calculado utilizando a seguinte fórmula:
Q1 + Q2 + Q3… = 0 ou ΣQ=0
Publicidade
Nesta, sendo:
Q, referente a quantidade de calor (temperatura dos corpos).
Dessa forma, concluímos que a soma de todas as energias térmicas existentes é nula.
Já referente ao calor sensível, o cálculo é relacionado à variável de temperatura percebida nos corpos. Sendo assim, ele será calculado a partir da seguinte fórmula:
Q = m . c . Δθ
Nesta, sendo:
- Q, referente a quantidade de calor sensível observada (cal ou J);
- m, referente à massa do corpo (g ou kg);
- c, referente ao calor específico do elemento (cal/gºC o J/gºC);
- Δθ, referente à variação da temperatura (°C ou K);
Referências
Física Básica – Volume Único, por Nicolau Gilberto Ferraro, Paulo de Toledo Soares e Ronaldo Fogo

Por Mateus Bunde
Graduado em Jornalismo pela Universidade Federal de Pelotas (UFPel), Especialista em Linguagens pelo Instituto Federal Sul-Rio-Grandense (IFSul) e Mestrando em Comunicação pela Universidade do Porto, de Portugal (UP/PT).
Bunde, Mateus. Equilíbrio Térmico. Todo Estudo. Disponível em: https://www.todoestudo.com.br/fisica/equilibrio-termico. Acesso em: 03 de April de 2025.
01. [FIEB] O copo interno de um calorímetro é feito de alumínio e tem massa de 30 g. Em seu interior, onde há 150 g de água pura à temperatura de 20 ºC, são despejados 200 g de bolinhas de aço que se encontram inicialmente à temperatura de 60 ºC. Sabendo que o calor específico do alumínio é 0,2 cal/g.ºC, o da água, 1 cal/g.ºC, e a temperatura de equilíbrio térmico do conjunto igual a 25 ºC, o calor específico do aço e a quantidade de calor trocada pelas bolinhas de aço com o sistema têm valores, respectivos e aproximadamente, iguais a
a) 0,11 cal/g.ºC e 780 cal, cedidas.
b) 0,11 cal/g.ºC e 780 cal, recebidas.
c) 0,55 cal/g.ºC e 890 cal, cedidas.
d) 0,55 cal/g.ºC e 890 cal, recebidas.
e) 0,88 cal/g.ºC e 780 cal, cedidas.
02. [UEA] Define-se a capacidade térmica de um corpo (C) como a razão entre a quantidade de calor que ele recebe (Q) e a correspondente variação de temperatura ocorrida (ΔT):
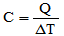
Se um corpo de capacidade térmica 25 cal/ºC recebe calor de uma fonte durante 20 minutos com taxa constante de 50 cal/min, ele sofre uma variação de temperatura, em ºC, igual a
a) 10,0.
b) 40,0.
c) 50,0.
d) 62,5.
e) 84,5.
01. [B]
02. [A]