Quando uma substância é pura, a sua temperatura se mantém constante durante sua mudança de fase. Porém, cada substância em cada mudança de fase necessita de uma certa quantidade de calor, cedido ou recebido, para que o processo ocorra. Esse calor que altera a fase da substância, mas mantém a temperatura constante, é chamado de calor latente e sua unidade no Sistema Internacional (S.I) é o J/kg (Joule por quilograma) mas comumente é utilizado o cal/g.
Publicidade
Dessa forma, iremos estudar um pouco mais sobre essa propriedade, a diferença entre ele e o calor sensível, alguns exemplos, sua fórmula e o seu gráfico.
Tipos de calor latente
Na natureza, de um modo simplificado, existem três tipos de estados da matéria, que são os estados sólido, líquido e gasoso. Assim, iremos estudar dois tipos de calor latente, o de fusão e o de vaporização.
Relacionadas
- Calor latente de fusão: é quando uma substância passa da fase sólida para a fase líquida. Um exemplo seria um cubo de gelo passando para a água em estado líquido;
- Calor latente de vaporização: ocorre quando uma determinada substância passa do estado líquido para o gasoso. A água em ebulição a 100°C seria um exemplo disso.
Quando a água passa do líquido para o sólido (solidificação) ela possui um calor latente de solidificação, tendo o mesmo valor do calor latente de fusão, porém com sinais contrários (LS = -LF). O mesmo vale para o calor latente de condensação (água passando do estado gasoso para o líquido) e o calor latente de vaporização.
Existe, ainda, um outro tipo de calor para cada substância, chamado de calor sensível. Esse calor está relacionado com a variação de temperatura da substância, ou seja, ele altera apenas a temperatura dessa substância quando ela perde ou ganha calor, não alterando seu estado físico.
Exemplos de calor latente
- Água aquecida a 100°C passando do estado líquido para o gasoso. Enquanto toda a água não virar vapor, a temperatura se manterá constante.
- Outro exemplo é quando pegamos uma garrafa de vidro com refrigerante muito gelada e instantaneamente o líquido se congela a uma temperatura constante. Isso se deve ao fato de que a temperatura do líquido está muito abaixo da temperatura de fusão.
- Ao jogarmos água em uma superfície muito quente ela se evapora quase que no mesmo instante. Esse fenômeno é conhecido como calefação e está relacionado com a absorção de calor latente.
Fórmula do calor latente
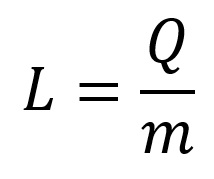
- Q: quantidade de calor (cal ou J);
- m: massa da substância que trocará de fase (g ou Kg);
- L: calor latente (cal/g ou J/Kg).
A fórmula é definida dividindo a quantidade de calor, fornecida ou cedida, por uma substância durante sua mudança de fase pela sua massa total, sendo a quantidade de calor fornecida em calorias ou Joule e a massa em gramas ou quilogramas.
Publicidade
Curva de aquecimento
A água, assim como as demais substâncias, altera de fase em determinadas temperaturas. Isso pode ser visto no gráfico da curva de aquecimento logo abaixo. Nos casos em que a temperatura é constante utilizamos o calor latente da água, o que seria nas duas partes em azul no gráfico.
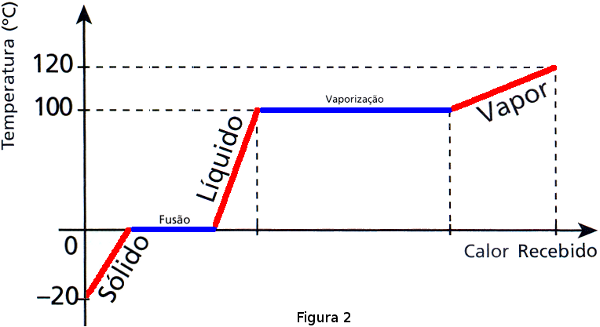
Essa curva relaciona a temperatura (eixo y) com a quantidade de calor fornecida para a substância (eixo x).
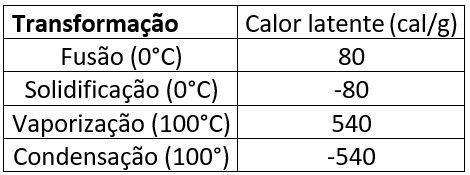
Tabela de calor latente
Publicidade
Para as condições normais de pressão e temperatura (1atm e 25°C), a água possui os valores de calor latente para cada transformação, que são apresentados na tabela acima.
Conforme a tabela, são necessários 80 calorias para congelarmos um grama de água que esteja na temperatura de 0°C. O sinal negativo significa que a transformação libera calor para realizar a troca de fase.
Por fim, o calor latente varia de substância para substância. O mercúrio necessita de um valor diferente de calorias para trocar de fase em relação a água, para uma mesma quantidade de massa. Dessa forma, é importante escolher sabiamente uma substância para fabricarmos uma panela, uma bacia de metal que vai ao fogo, entre outras coisas.
Referências
Física para o ensino médio, vol. 2: mecânica – Kazuhito Yamamoto;
As faces da física – Wilson Carron.

Por Guilherme Santana da Silva
Graduado no curso de Física pela Universidade Estadual de Maringá. Professor assistente em um colégio de ensino médio e preparatório para os vestibulares. Nas horas vagas se dedica à vida religiosa, praticar mountain bike, tocar bateria, dar atenção à família e cuidar de suas duas gatinhas Penélope e Mel.
Santana, Guilherme. Calor latente. Todo Estudo. Disponível em: https://www.todoestudo.com.br/fisica/calor-latente. Acesso em: 02 de April de 2025.
1. [Unifor-CE]
O gráfico representa a temperatura de uma amostra de massa 100g de determinado metal, inicialmente sólido, em função da quantidade de calor por ela absorvida.
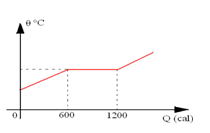
Pode-se afirmar que o calor latente tem fusão desse metal, em cal/g é:
a) 12
b) 10
c) 8
d) 6
e) 2
Sabemos que a equação do calor latente é
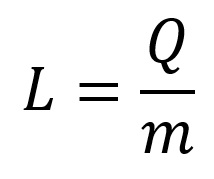
Sabemos que o calor latente é utilizado quando existe troca de estado físico, ou seja, quando a temperatura é constante. Assim, pelo gráfico, temos que Q = 600cal e m = 100g, logo
L = 600/100
L = 6 cal/g
RESPOSTA d)
2. [Vunesp-SP]
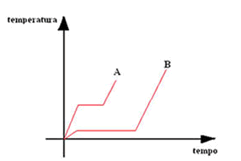
A figura mostra os gráficos das temperaturas em função do tempo de aquecimento, em dois experimentos separados, de dois sólidos, A e B, de massas iguais, que se liquefizeram durante o processo. A taxa com que o calor é transferido no aquecimento é constante e igual nos dois casos.
Se Ta e Tb forem as temperaturas de fusão e L a e L b os calores latentes de fusão de A e B, respectivamente, então:
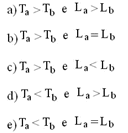
O nível que o gráfico apresenta para mudança de estado (fusão) corresponde a uma temperatura maior para o sólido A, comparando as temperaturas de fusão tem-se:
Ta > Tb
A extensão desse nível é maior para o sólido B indicando que a quantidade de calor recebida pelo sólido B é maior que a recebida pelo sólido A.
Qa > Qb