O diagrama de Linus Pauling é uma ferramenta que auxilia na distribuição eletrônica dos átomos e íons por seus níveis e subníveis de energia. Também chamado de “princípio da estruturação”, foi proposto, tendo como base, o modelo atômico de Bohr e as sete camadas eletrônicas dos átomos. Entenda o que é e como ler um diagrama de Linus Pauling.
Publicidade
O que é o diagrama de Linus Pauling?
Também conhecido como princípio da estruturação, esse diagrama é uma representação da distribuição de elétrons pelas camadas de eletrônicas, ou seja, ele tem como base os subníveis de energia s, p, d e f para a organização dos elétrons em ordem crescente de energia.
Relacionadas
Para que serve o diagrama de Linus Pauling
O diagrama de Linus Pauling é utilizado para realizar a distribuição dos elétrons de um átomo, modo que facilita o entendimento da estrutura atômica dos elementos químicos tanto em seus estados fundamentais (neutros) quanto na forma iônica (com deficiência ou excesso de elétrons). Além disso, é uma ferramenta que permite determinar a quantidade de elétrons na camada de valência dos átomos, quais são os elétrons que possuem maior energia, a quantidade de orbitais e outras características atômicas.
Como funciona o diagrama de Linus Pauling
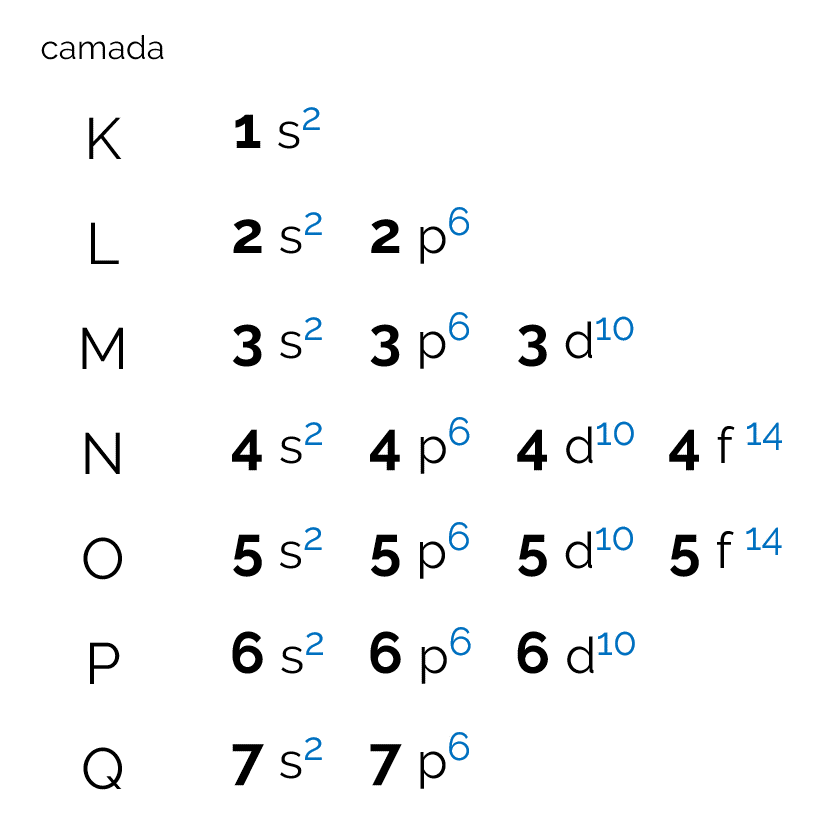
O diagrama representa as sete camadas eletrônicas que um átomo pode apresentar (K, L, M, N, O, P e Q). Cada camada dessa pode ter uma quantidade determinada de subníveis, orbitais e, consequentemente, elétrons máximos que ela comporta. O diagrama é montado na forma diagonal para que a distribuição seja feita em ordem crescente de energia. Veja, a seguir, o que significa cada termo correlacionado com o diagrama de Pauling.
Níveis
Os níveis, ou camadas eletrônicas, correspondem aos orbitais que um átomo pode ter, conforme a quantidade de elétrons que possui. É representado com as letras maiúsculas de K até Q, em ordem, ou pelos números de 1 até 7. Cada camada possui uma quantidade específica de energia de modo que a camada K é a que possui menor energia e, consequentemente, a Q é a mais energética.
Subníveis
Cada nível apresenta uma quantidade diferente de subníveis, representados pelas letras minúsculas s, p, d e f. São nesses subníveis que os elétrons têm maior probabilidade de se localizarem. Veja a quantidade de subníveis que cada camada eletrônica pode conter:
Publicidade
- K: um subnível (s);
- L: dois subníveis (s, p);
- M: três subníveis (s, p, d);
- N: quatro subníveis (s, p, d, f);
- O: quatro subníveis (s, p, d, f);
- P: três subníveis (s, p, d);
- Q: dois subníveis (s, p);
Orbitais
Cada subnível, de modo semelhante, possui uma quantidade diferente de orbitais. Cada orbital comporta, no máximo, dois elétrons. Durante o estudo de distribuição eletrônica, os orbitais são geralmente representados como quadrados, por isso são chamados “casa dos pares de elétrons”. A quantidade de orbital e, consequentemente, o número máximo de elétrons que cada um comporta é:
- s: um orbital, dois elétrons;
- p: três orbitais, seis elétrons;
- d: cinco orbitais, dez elétrons;
- f: sete orbitais, quatorze elétrons.
Quantidade máxima de elétrons
Sendo assim, tendo a quantidade de subníveis e orbitais de cada camada eletrônica dos átomos, é possível determinar a quantidade máxima de elétrons que cada um dos níveis suporta.
- K: 2 elétrons;
- L: 8 elétrons;
- M: 18 elétrons;
- N: 32 elétrons;
- O: 32 elétrons;
- P: 18 elétrons;
- Q: 8 elétrons;
Dessa maneira, é possível fazer a distribuição eletrônica de todos os elementos da tabela periódica, visto que a soma de todos os elétrons que as camadas suportam é igual a 118, mesmo número atômico do último elemento conhecido na tabela periódica. Para o caso dos íons, a quantidade de elétrons deve ser correspondente à carga: o valor da carga é somado (para os ânions) ou subtraído (para os cátions) à quantidade de elétrons do átomo neutro e a distribuição é feita normalmente.
Publicidade
Como ler o diagrama de Linus Pauling
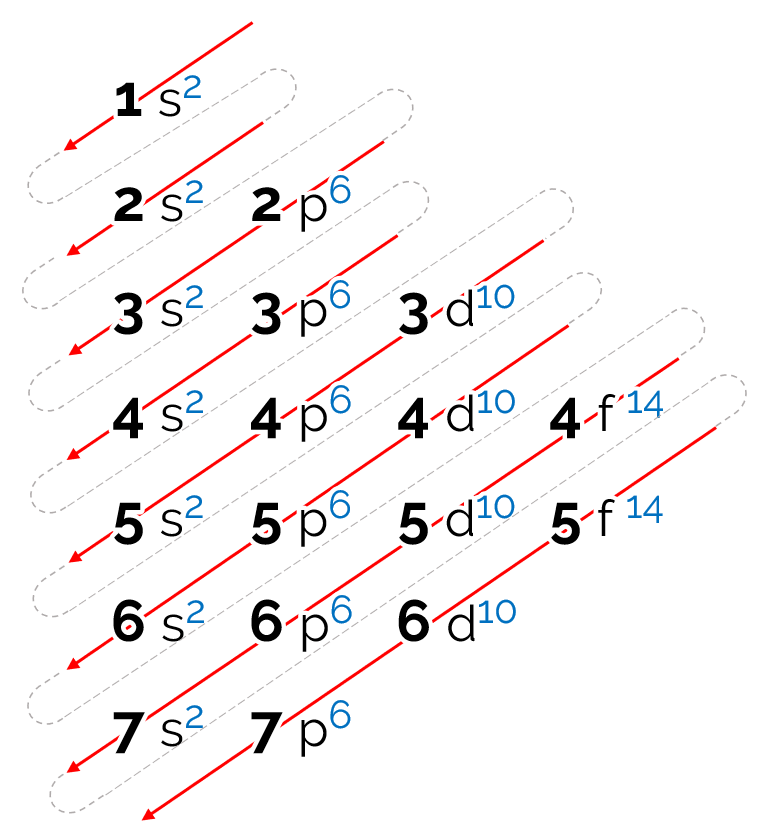
A ordem de energia estabelecida para esse diagrama é na forma diagonal, representado pelas setas em vermelho na imagem acima. É por conta disso que ele também pode ser chamado de diagrama das diagonais. A leitura começa no subnível de menor energia (1s). Seguindo a ordem das setas, o próximo é o subnível 2s. Em seguida, vem o 2p e assim sucessivamente até chegar ao subnível p da camada 7. Os elétrons dos átomos são distribuídos de modo a preencher completamente cada subnível.
Dessa forma, a sequência da distribuição eletrônica é dada na seguinte ordem: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6.
Vídeos sobre a distribuição eletrônica de Linus Pauling
Agora que o conteúdo já foi apresentado, veja alguns vídeos selecionados para auxiliar na assimilação do tema estudado.
Como montar o diagrama de Linus Pauling
Entenda a origem do diagrama de Pauling para a distribuição eletrônica por quantidade de energia. Veja cada termo usado nesse conteúdo, tendo uma compreensão da quantidade de elétrons máxima que cada nível e subnível pode comportar. Sendo assim, aprenda a montar o diagrama de Linus Pauling para usar na resolução de exercícios de distribuição eletrônica.
Fazendo a distribuição eletrônica com o princípio da estruturação
Uma das funções do diagrama de Pauling é a distribuição dos elétrons que um átomo possui. O número de elétrons é o igual ao número atômico dos elementos químicos. Dessa forma, é possível saber como os elétrons estão organizados na eletrosfera de um átomo. Veja como distribuir corretamente todos os elétrons de diferentes elementos da tabela periódica.
Exercícios para pôr em prática a distribuição eletrônica
O conteúdo de distribuição eletrônica é cobrado de inúmeras formas nas provas e vestibulares. Veja alguns exemplos desses exercícios e saiba como respondê-los corretamente partindo do princípio da estruturação. Perceba que depois de fazer a distribuição eletrônica, muitas informações com relação às características atômicas podem ser obtidas e ajudar na interpretação das questões.
Em síntese, o diagrama de Linus Pauling é uma ferramenta que facilita a distribuição eletrônica tanto de átomos em seus estados fundamentais quanto de íons. Muitas informações podem ser obtidas com esse diagrama, como a distribuição eletrônica. Não pare de estudar por aqui, veja mais sobre o número de massa, mais uma informação importante dos átomos.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Inorgânica(1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Diagrama de Linus Pauling. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/diagrama-de-linus-pauling. Acesso em: 04 de April de 2025.
1. [USC-RS]
Os dias dos carros com luzes azuis estão contados, pois, desde 1º de janeiro de 2009, as lâmpadas de xenônio (Xe) não podem mais ser instaladas em faróis convencionais. Mesmo que as lâmpadas azuis possibilitem três vezes mais luminosidade do que as convencionais, elas não se adaptam adequadamente aos refletores feitos para o uso com lâmpadas convencionais, podendo causar ofuscamento à visão dos motoristas que trafegam em sentido contrário e possibilitando, assim, a ocorrência de acidentes. Quantos elétrons o gás xenônio apresenta na camada de valência?
a) 2.
b) 6.
c) 8.
d) 10.
e) 18.
O Xenônio é um gás nobre que apresenta número atômico 54, ou seja, a quantidade de elétrons que ele possui é 54 também. Com o diagrama de Linus Pauling, é possível fazer a distribuição desses 54 elétrons. Fica da seguinte forma:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
A camada de valência é aquela correspondente ao maior nível que se mostra na distribuição eletrônica. Nesse caso, é a camada 5. A quantidade de elétrons total nessa camada é a soma dos elétrons nos subníveis:
5s2 5p6
2 + 6 = 8 elétrons.
Dessa forma, a alternativa correta é a letra c) 8.
2. [UniRIO]
“Os implantes dentários estão mais seguros no Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de confecção dos parafusos e pinos de titânio, que compõem as próteses. Feitas com ligas de titânio, essas próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras, nos ossos da mandíbula e do maxilar.” (Jornal do Brasil, outubro 1996).
Considerando que o número atômico do titânio é 22, sua configuração eletrônica será:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Fazendo a soma de todos os elétrons de cada alternativa
a) 2 + 2 + 6 + 2 + 3 = 15 elétrons.
b) 2 + 2 + 6 + 2 + 5 = 17 elétrons.
c) 2 + 2 + 6 + 2 + 6 + 2 = 20 elétrons.
d) 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22 elétrons.
e) 2 + 2 + 6 + 2 + 6 + 10 + 6 = 34 elétrons
Portanto, a alternativa correta é a d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2, visto que o número atômico do Ti é 22, correspondente a quantidade de elétrons que possui.