Ânodo e cátodo são componentes, chamados de eletrodos, em pilhas eletroquímicas. Também conhecidas como células galvânicas, elas consistem em dispositivos que transformam a energia de uma reação química em corrente elétrica. Ao contrário da eletrólise, a reação de oxirredução nas pilhas ocorre de maneira espontânea. A seguir, saiba mais sobre cada um dos eletrodos de uma pilha.
Publicidade
O que é ânodo
O ânodo é o eletrodo em que ocorre um acumulo de elétrons, portanto é o que tem polaridade negativa da célula eletroquímica. Nele ocorrem as semi-reações de oxidação, sendo assim, ocorre a emissão de elétrons para o circuito externo. Como o metal que constitui o ânodo é o que sofre oxidação, ele é o que possui o menor potencial de redução (EoRED).
Relacionadas
Essa oxidação do metal do ânodo faz com que ele passe da forma metálica (NOX = 0) para a sua forma iônica, ou seja, ele se dissolve. Com o experimento da célula galvânica é possível observar que a placa de metal (geralmente zinco) do eletrodo perde massa e a concentração de Zn2+(aq) em solução aumenta, com o tempo. Isso evidencia o que acontece na semi-reação de oxidação, onde zinco metálico perde elétrons e se transforma em um íon:
Zno → Zn2+(aq) + 2 e–
O que é cátodo
O cátodo é o oposto do ânodo. Nele ocorre um ganho de elétrons, originados do ânodo. Sendo assim, a polaridade do eletrodo tende a ser positiva e ocorrem reações de redução na região.
A redução faz com que o metal do cátodo (cobre), presente na sua forma iônica na solução eletrolítica, seja depositado na placa metálica, ocorrendo um aumento de sua massa e, consequentemente, uma diminuição da concentração de íons Cu2+(aq) em solução.
Publicidade
Cu2+(aq) + 2 e– → Cuo
Aplicação do ânodo e cátodo
Como comentado, o ânodo e cátodo são, respectivamente, os polos negativos e positivos de uma célula galvânica. Após estudos e aprimoramentos, pesquisadores acabaram utilizando tais reações de oxirredução espontâneas e que geram corrente elétrica para transformar o dispositivo experimental em um item muito utilizado no cotidiano, que são as pilhas e baterias.

A pilha é uma célula eletroquímica constituída de um cátodo de grafite que se encontra no centro do dispositivo, recoberto por uma mistura pastosa de diversos compostos químicos que agem como a solução eletrolítica. Já o polo negativo da pilha é uma placa cilíndrica de zinco. Conforme a composição do material interno dessa pilha seca, ela recebe nomes diferentes.
Publicidade
A pilha comum é chamada de pilha ácida, pois contém cloreto de amônio em seu interior. Nela o processo de oxirredução é irreversível, por isso dizemos que a “pilha acabou” quando ela para de funcionar. Uma pilha alcalina tem esse nome porque a pasta interna que a constitui possui caráter básico. Apesar de também não ser recarregável, ela é mais duradoura que a pilha comum, visto que sua pasta é uma melhor condutora eletrolítica, resultando em uma resistência interna menor.
Sendo assim, é possível constatar a presença do ânodo e cátodo no cotidiano, na forma dos polos negativos e positivos de pilhas e baterias que são utilizadas em diversos dispositivos que necessitam de eletricidade para funcionar, como controles remotos, relógios, lanternas, entre outros.
Vídeos sobre o ânodo e cátodo
Agora que o conteúdo foi apresentado, veja alguns vídeos para ajudar a assimilar o tema estudado.
Ânodo e cátodo são constituintes de uma pilha
Uma pilha eletroquímica, também chamada de pilha galvânica, é um exemplo da aplicação do ânodo e cátodo. Nela cada componente se encontra em recipientes distintos, unidos por uma ponte salina, que faz o equilíbrio de cargas entre as soluções conforme a reação de oxirredução acontece. Veja como é a configuração desse tipo de pilha, conhecendo os constituintes e as reações envolvidas.
Ânodo é o polo negativo e o cátodo o positivo
Um tópico muito cobrado em vestibulares e no ENEM é a eletroquímica. Isso porque é um assunto com diversos termos semelhantes e que são facilmente confundidos. Com esse vídeo, aprenda definitivamente os nomes envolvidos em um processo eletroquímico, sabendo dizer em quais regiões ocorrem as reações de oxidação ou redução, como é o nome dos polos da pilha, entre outras.
Revisão sobre a química de pilhas
Ânodo e cátodo são partes importantes de uma pilha eletroquímica. No ânodo, ocorrem as reações de oxidação com acúmulo de elétrons e corrosão do eletrodo. Consequentemente, é o polo negativo da pilha. Em contrapartida, no cátodo, ocorrem as reações de redução, com deposição de metal na placa e consumo de elétrons, portanto é o polo positivo da pilha. Veja isso e mais com esse resumo do conteúdo de eletroquímica.
Em síntese, o ânodo é o polo negativo de uma célula eletrolítica, enquanto o cátodo é polo positivo. É possível transformar energia de uma reação de oxirredução que acontece nos eletrodos para utilizar como energia elétrica no funcionamento de diferentes dispositivos eletrônicos presentes no cotidiano. Não pare de estudar por aqui, veja também sobre o processo de oxidação.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Fundamentos de Química Analítica (1963) – Douglas A. Skoog, Donald M. West, F. James Holler e Stanley R. Crouch
Química Analítica (1971) – Gary D. Christian

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Ânodo e cátodo. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/anodo-e-catodo. Acesso em: 31 de March de 2025.
1. [PUC]
Na cela eletroquímica representada pela equação:
Ni0 + 2 Ag+ → Ni2+ + 2 Ag0
é correto afirmar que:
a) os elétrons fluem, pelo circuito externo, da prata para o níquel.
b) o cátodo é o eletrodo de níquel.
c) o eletrodo de prata sofre desgaste.
d) a prata sofre redução.
e) a solução de níquel irá se diluir.
A reação mostrada é a reação global constituída das semi-reações:
Ânodo: Ni0 → Ni2+ + 2 e–
Cátodo: Ag+ + e– → Ag0
Portanto, analisando as alternativas:
a) ERRADA. É o sentido contrário, do níquel para a prata, já que o níquel perdeu elétrons e a prata ganhou.
b) ERRADA. O cátodo é o de prata, visto que ele sofreu a redução.
c) ERRADA. Nesse eletrodo ocorre a deposição de prata metálica, pela formação de Ag0.
d) CORRETA. Sofre redução de Ag+ para Ag0 pelo ganho de elétrons.
e) ERRADA. Acontece a formação de Ni2+ em solução, o que proporciona o aumento da concentração.
2. [ENEM - 2019]
Grupos de pesquisa em todo o mundo, vêm buscando soluções inovadoras, visando à produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
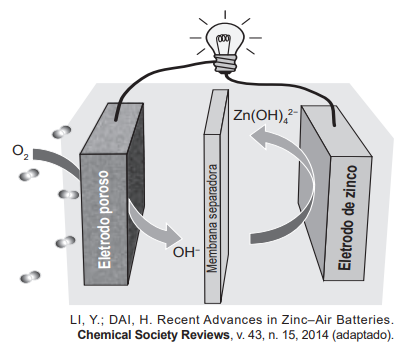
No funcionamento da bateria, a espécie química formada no ânodo é:
a) H2 (g).
b) O2 (g).
c) H2O (l).
d) OH−(aq).
e) Zn(OH)42−(aq).
No ânodo ocorrem as reações de oxidação, ou seja, uma espécie passa a ter um número de oxidação maior que o inicial. Na bateria de zinco-ar, as reações envolvidas são
1/2 O2 (g) + H2O(l) + 2 e– → 2 OH–
Zn(s) + 4 OH –(aq) → Zn(OH)42-(aq) + 2 e–
Na primeira, gás oxigênio passa do NOX = 0 de cada átomo de oxigênio, para o NOX = -2 na molécula de OH–, ou seja, sofreu uma redução.
Já na segunda semi-reação, o zinco passa de NOX = 0 do zinco metálico para NOX = +2 na molécula de Zn(OH)42-, ou seja, sofreu uma oxidação.
Sendo assim, o produto formado no ânodo é o correspondente a alternativa e) Zn(OH)42−(aq).