Os números quânticos referem-se à forma como diferenciamos os elétrons de um determinado átomo, exceto quando estão isolados em repouso, que são exatamente iguais. Para compreendermos melhor, vamos analisar comparativamente. Quando vamos diferenciar o endereço das pessoas ao receberem cartas ou encomendas. Nos correios, temos um padrão determinado por quatro “números” que podem diferenciar nossa localização. São eles o endereço, a cidade, a rua e o número da residência. O mesmo acontece com os elétrons, que são diferenciados a partir de quatro números, que são denominados números quânticos. O primeiro deles, é denominado número quântico principal (n), o segundo é o número quântico azimutal ou secundário (i), o terceiro é denominado número quântico magnético (m) e o último é denominado número quântico spin (ms). Abaixo, vamos compreender melhor cada um deles.
Publicidade
Número quântico principal
O número quântico principal, representado pela letra n, tem valores inteiros que vão de 1 à infinito, e representam a distância aproximada do elétron ao núcleo. São responsáveis, portanto, pela determinação da energia do elétron, assim como do tamanho do orbital ocupado por ele e da distância entre o orbital e o núcleo. Podemos dizer que a distância média entre o orbital 7s e o núcleo é maior do que a distância média entre o orbital 1s e o núcleo.
Número quântico azimutal ou secundário
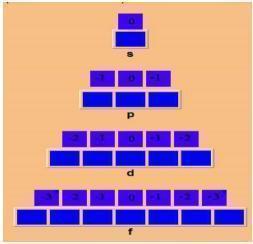
O número quântico azimutal, por sua vez, representa a forma do orbital. Os orbitais s são esféricos, enquanto os orbitais p apresentam-se na forma de halteres, ou de um 8, entre outros. É representado pela letra I, maiúscula. Quando o átomo apresenta muitos elétrons, a energia de um deles pode ser determinada não apenas pelo valor de n, mas também de I.
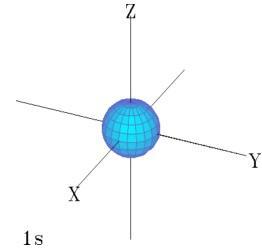

Número quântico magnético
O número quântico magnético, por sua vez, representado pela letra m, é usado para a descrição da orientação do orbital no espaço. “m” pode apresentar valores inteiros entre + I e – I, incluindo zero. Confira abaixo um exemplo:
Número quântico spin
O número quântico spin, finalmente, é usado para descrever a rotaão do elétron em torno de seu eixo, sendo representado por ms. Pode apresentar, somente, os valores + ½ e – ½. Quando dois elétrons estiverem em um mesmo orbital e apresentarem os três primeiros números quânticos iguais, apresentarão o spin oposto. Com isso, podemos concluir que, dois elétrons de um mesmo átomo jamais terão os mesmos quatro números quânticos.
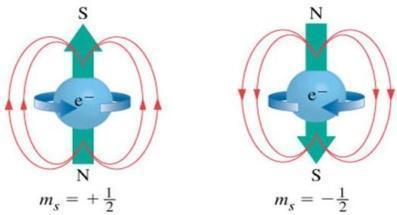
Publicidade
Referências
Química – Edgard Salvador, João Usberco

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Números quânticos. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/numeros-quanticos. Acesso em: 19 de April de 2025.
01. [UEPI] Sobre o elemento químico vanádio, de número atômico 23, são feitas as seguintes afirmações:
I. A camada de valência do vanádio possui três (3) elétrons;
II. Possui onze (11) elétrons na terceira camada eletrônica;
III. Os quatro números quânticos para os elétrons da última camada são : 3 ; 2 ; 0 ; + 1/2;
IV. A camada de valência do vanádio possui dois (2) elétrons.
Indique a alternativa correta:
a) somente as afirmações II e IV estão corretas.
b) somente as afirmações I e II estão corretas.
c) somente as afirmações III e IV estão corretas.
d) somente as afirmações I e III estão corretas.
e) somente as afirmações I e IV estão corretas.
02. [Uespi] Dado o átomo 17X, o conjunto dos quatro números quânticos para o 11º elétron do subnível p é:
a) 3, 1, 0 e – 1/2.
b) 3, 1, 1 e – 1/2.
c) 3, 1, 0 e + 1/2.
d) 3, 2, 0 e – 1/2.
e) 3, 2, 0 e + 1/2.
01. [A]
02. [C]