O antimônio (Sb) também é chamado de estíbio por conta da origem do nome em latim (stibium). Os compostos originados a partir desse elemento são utilizados desde os primórdios da antiguidade em cosméticos e medicamentos. Sua forma metálica é utilizada em ligas compostas de outros metais para obtenção de materiais mais resistentes.
Publicidade
O que é o antimônio?
O antimônio é um elemento químico do grupo 5A, classe dos semimetais, ou metaloides, de número atômico 51 e massa atômica 121,76 u. Em seu estado metálico é um sólido de coloração prateada e quebradiço. Na natureza é encontrado na sua forma de sulfeto (Sb2S3), no mineral estibina (ou antimonita). Esse elemento e seus compostos possui algumas propriedades importantes, são elas:
Relacionadas
- Símbolo atômico Sb;
- É um metaloide, se assemelha a metais em aspecto físico, mas quimicamente é bem diferente;
- É um sólido cristalino fundível, ou seja, derrete, além de ser resistente à ácidos;
- Quebradiço, além de ter baixa condutividade térmica e elétrica;
- Forma óxidos, sulfetos, hidróxidos e haletos.
Em síntese, o antimônio é um elemento químico com diversas características que fazem com que seja confundido com um metal, principalmente por conta de sua aparência. Porém, ele reage com outros elementos e seus aspectos químicos são bem distintos, por isso se encaixa na classe dos semimetais.
Aplicações do antimônio
Como já dito, desde a antiguidade o antimônio é utilizado em diferentes ocasiões. Os egípcios, por exemplo, faziam uma espécie de sombra de olho, chamada de kohl a partir do sulfeto de antimônio, a estibina, encontrada como minério. Desde então, muitas aplicações para seus compostos têm sido desenvolvidas. Acompanhe:
Ligas metálicas
A principal aplicação do elemento metálico é na fabricação de ligas metálicas com chumbo, que é usada para confecção de baterias de carro, projéteis e melhoria nas propriedades de soldas. Quando cerca de 5% de antimônio é incorporado ao chumbo, depois que o metal resfria, ele se torna muito mais resistente.
Retardante de chama
Compostos óxidos de Sb possuem a característica de serem resistentes ao fogo. Isso é muito útil na confecção de colchões, espumas e roupas anti-chamas de bombeiros. O óxido de antimônio é incorporado ao polímero, fazendo com que, em caso de exposição ao fogo, o material deixa de ser inflamável.
Publicidade
Catalisador de reação e estabilizante
Durante a produção de politereftalato de etileno, o plástico PET, o antimônio é utilizado como catalisador da reação para que o processo ocorra mais rapidamente. Além disso, age como estabilizante do produto final, garantindo as propriedades dos plásticos presentes nas garrafas PET.
Medicamento para Leishmaniose
Remédios feitos à base de antimônio são utilizados para o tratamento de Leishmaniose em animais domésticos, sendo um remédio que não causa danos para a medula óssea, ao contrário de outros tratamentos.
Apesar de possuir diversas aplicações, o antimônio não é tão abundante na crosta terrestre em sua forma elementar, mas sim em sua forma de minério, principalmente a estibina. Por isso, é necessário um pré-tratamento do minério para extração do Sb puro e seus diversos usos.
Publicidade
A toxicidade do antimônio
Depende do estado químico em que ele se encontra. Na forma elementar, é relativamente inerte. No entanto, a estibina é altamente tóxica, exigindo que seu manuseio seja feito em ambientes ventilados para que não ocorra uma contaminação do ambiente. A exposição causa dermatites e se consumido, em doses baixas, pode causar dores de cabeça, depressão e fraqueza. Já em doses elevadas pode levar a morte.
Curiosidades sobre o elemento químico
Vamos ver agora algumas curiosidades sobre esse elemento químico.
- Usado em maquiagem, na fabricação de sombras, em sua forma de sal de antimônio
- Já foi utilizado como medicamento para indução de vômito, mas o uso em excesso causava a morte, devido sua toxicidade.
- No final da Idade Média, pílulas de antimônio eram utilizadas como laxante, já que após a ingestão do comprimido, o intestino ficava irritado, causando a diarreia.
- Existe a crença de que o famoso Fogo Grego, usado como arma em guerras navais, possuía a estibina em sua composição com salitre e petróleo. Isso porque ele continuava queimando mesmo em contato com a água.
Hoje em dia, os usos para esse elemento estão bem mais limitados e controlados, justamente por todo conhecimento acumulado acerca dos riscos envolvidos do seu consumo excessivo de compostos originados do antimônio.
Vídeos sobre o elemento extraído da estibina
Agora que já temos conhecimento sobre esse semimetal, vamos dar uma olhada em alguns vídeos que nos ajudam a fixar melhor o conteúdo.
As aplicações do antimônio
O antimônio é um elemento presente em diversas ligas de chumbo para melhorar as propriedades do material e possui outras aplicações em diversos campos. Nesse vídeo, saiba mais quais são essas aplicações, além de algumas características químicas do elemento.
História do elemento e suas características
Desde a antiguidade o antimônio já era utilizado como medicamentos ou em alguns cosméticos. Conheça mais da história do elemento e se aprofunde bastante nas suas propriedades químicas.
Os isótopos estáveis do antimônio
Nesse vídeo, temos a resolução de uma questão de química do ENEM de 2009, que trata dos isótopos do antimônio. Aproveite para fixar o conteúdo estudado.
Em conclusão, o antimônio é um metaloide que possui diversas aplicações em inúmeros campos da tecnologia. Não pare seus estudos por aqui, conheça mais sobre outra classe de elementos químicos, os metais pesados.
Referências
Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente (2005) – Peter Atkins e Loretta Jones
The Elements – A Visual Exploration of Every Known Atom in the Universe. (2009) Theodore Gray
Química Inorgânica (1992) – Peter Atkins, Duward F. Shriver e Cooper H. Langford

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Antimônio. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/antimonio. Acesso em: 03 de April de 2025.
1.
Das alternativas a seguir, assinale aquela que apresenta, respectivamente, um metaloide e um metal alcalino:
a) Hidrogênio e Hélio
b) Germânio e Antimônio
c) Hélio e Cloro
d) Enxofre e Antimônio
e) Antimônio e Sódio
Os elementos são classificados como:
a) Sem classe e gás nobre
b) Metaloide e metaloide
c) Gás nobre e halogênio
d) Não-metal e metaloide
e) Metaloide e metal alcalino
Então, a alternativa certa é a letra E.
2.
Os núcleos dos átomos são constituídos de prótons e nêutrons, sendo ambos os principais responsáveis pela sua massa. Nota-se que, na maioria dos núcleos, essas partículas não estão presentes na mesma proporção. O gráfico mostra a quantidade de nêutrons (N) em função da quantidade de prótons (Z) para os núcleos estáveis conhecidos.
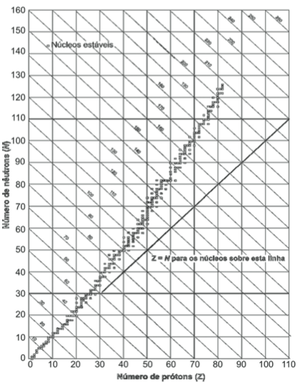
O antimônio é um elemento químico que possui 50 prótons e possui vários isótopos ― átomos que só se diferem pelo número de nêutrons. De acordo com o gráfico, os isótopos estáveis do antimônio possuem
A – entre 12 e 24 nêutrons a menos que o número de prótons.
B – exatamente o mesmo número de prótons e nêutrons.
C – entre 0 e 12 nêutrons a mais que o número de prótons.
D – entre 12 e 24 nêutrons a mais que o número de prótons.
E – entre 0 e 12 nêutrons a menos que o número de prótons.
No enunciado, foi dito que o antimônio possui 50 prótons. Analisando o gráfico, é possível observar que os isótopos estáveis do antimônio possuem de 62 a 74 nêutrons, ou seja, possuem entre 12 e 24 nêutrons a mais que o número de prótons. Portanto a alternativa correta é a letra D, entre 12 e 24 nêutrons a mais que o número de prótons.