Existem ao nosso redor uma grande quantidade de diferentes substâncias que apresentam diferenças entre si com relação à cor, estado físico, densidade, cheiro, sabor, pontos de fusão e ebulição, entre outras coisas. Isso acontece porque os átomos se combinam entre si para realizar ligações químicas, sendo eles do mesmo elemento ou de um elemento diferente. No ano de 1920, essa propriedade ficou conhecida pelo nome de chemical bond, ou ligação química em português, e foi o químico Gilbert Newton Lewis que criou essa denominação.
Publicidade
O cientista, em parceria com Walter Kossel, no ano de 1916, observaram que apenas os gases nobres eram encontrados de forma isolada no meio, isso por possuírem a camada de valência de seus átomos preenchida com oito elétrons. A partir dessa observação, assim como das ligações que acontecem entre os átomos de elementos das outras famílias da tabela, criaram a teoria do octeto, que diz “Um átomo adquire estabilidade quando possui oito elétrons na camada eletrônica mais externa, ou dois elétrons quando possui apenas uma camada”.
Com isso, podemos dizer que o átomo faz uma troca de elétrons, recebendo, doando ou compartilhando-os objetivando que sua camada de valência permaneça com oito elétrons.
Tipos de ligações químicas
Ligação iônica
A ligação iônica é aquela que ocorre entre íons, ou seja, entre cátions e ânions, e também é conhecida pelo nome de ligação eletrovalente. Íons são aqueles átomos que possuem uma carga elétrica por adição ou pela perda de um ou mais elétrons.
Ligação covalente
A ligação molecular ou covalente é aquela em que há o compartilhamento de elétrons para que se formem moléculas estáveis de acordo com a teoria do octeto, não havendo, portanto, perda ou ganho de elétrons. Chamamos de pares eletrônicos os elétrons que foram cedidos pelos núcleos, o que figurou o compartilhamento dos elétrons das ligações covalentes. Por exemplo, quando analisamos a fórmula da água, podemos notar que é formada por dois átomos de hidrogênio e um de oxigênio. Ao desmembrarmos a fórmula H2O temos: H – O – H, sendo que os traços correspondem a um par de elétrons que está sendo compartilhado, formando uma molécula neutra. Isso porque não há nem perda nem ganho de elétrons quando se trata desse tipo de ligação.
Ligação covalente dativa
As ligações covalentes dativas, também conhecidas pelo nome de ligações coordenadas, acontecem quando há a presença de um octeto completo em um dos átomos: um deles possui oito elétrons na última camada enquanto o outro precisa, para se estabilizar eletronicamente, adquirir dois elétrons. Como exemplo, podemos citar o Dióxido de enxofre, representado por SO2: O = S – > O. Esse tipo de ligação é representado por uma seta. Há uma dupla ligação do enxofre com um dos oxigênios, objetivando a estabilidade eletrônica. Além disso, o enxofre ainda doa um par dos elétrons para que o outro oxigênio fique com oito elétrons em sua camada de valência.
Ligação metálica
Chamamos de ligações metálicas aquelas ligações que ocorrem entre os metais, que são elementos com ótima condução térmica e elétrica, e são considerados eletropositivos. Para isso, alguns dos metais acabam por perder os elétrons livres de sua última camada de valência, formando, dessa forma, os cátions. Diante disso, os elétrons que foram liberados na ligação acabam formando uma nuvem eletrônica, que também pode ser referida pelo nome mar de elétrons.
Publicidade
Referências
Princípios de química – Loretta Jones, Peter Atkins

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Ligações químicas. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/ligacoes-quimicas. Acesso em: 02 de April de 2025.
01. [UFU-MG] O fosgênio (COCl2), um gás, é preparado industrialmente por meio da reação entre o monóxido de carbono e o cloro. A fórmula estrutural da molécula do fosgênio apresenta:
a) uma ligação dupla e duas ligações simples.
b) uma ligação dupla e três ligações simples.
c) duas ligações duplas e duas ligações simples.
d) uma ligação tripla e duas ligações simples.
e) duas ligações duplas e uma ligação simples.
02. [Unifor] À molécula de água, H2O, pode-se adicionar o próton H+, produzindo o íon hidrônio H3O+.
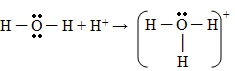
Formação do íon hidrônio
No hidrônio, quantos pares de elétrons pertencem, no total, tanto ao hidrogênio quanto ao oxigênio?
a) 1.
b) 2.
c) 3.
d) 4.
e) 6.
01. [A]
02. [C]