Alcenos são uma classe de hidrocarbonetos compostos por uma ou mais ligação dupla entre carbonos. Esses compostos são difíceis de serem encontrados na natureza. Por isso, são formulados em laboratório e estão presentes no nosso dia a dia na principalmente na forma de plástico. Continue a leitura para conhecer mais sobre essa classe.
Publicidade
O que são alcenos?
Os alcenos são compostos hidrocarbonetos de cadeia aberta que apresentam uma insaturação em sua estrutura molecular, ou seja, uma ligação dupla entre dois átomos de carbono. Sua fórmula geral é CnH2n, em que n é o número de carbonos. Quando a molécula possui duas insaturações, é chamada de alcadieno, com fórmula geral CnH2n-2
Relacionadas
Visto que os alcenos quase não existem naturalmente no planeta Terra, somente uma pequena quantidade é extraída do petróleo. A grande maioria é, portanto, preparada sintetizada em laboratórios.
Características dos alcenos
- São incolores e insolúveis em água;
- Solúveis em solventes orgânicos de caráter apolar, como o éter de petróleo;
- Comparados com os alcanos de mesmo número de carbonos, têm maior ponto de fusão e ebulição;
- Mais reativos que os seus respectivos alcanos;
- São compostos apolares;
- Compostos combustíveis;
- Possuem odor forte.
Além disso, os alcenos se apresentam no estado gasoso se tiverem até quatro carbonos na estrutura. De cinco até dezesseis carbonos, são líquidos. A partir de dezessete, passam a ser sólidos, com o ponto de fusão aumentando conforme se aumenta o número de carbono.
Nomenclaturas dos alcenos
Antes de mais nada, é necessário saber que a nomenclatura dos alcenos é dada da mesma forma que a dos hidrocarbonetos comuns, mudando o final de “ano” para “eno”, indicando a dupla ligação. O prefixo indica a quantidade de carbonos na cadeia principal.
Publicidade
Em casos de cadeia ramificada, é necessário indicar as ramificações no início da palavra. Quando a molécula é cíclica, o termo “ciclo” aparece antes do prefixo que indica a quantidade de carbonos. Por fim, quando as moléculas tiverem mais de 4 carbonos, sempre é preciso indicar a posição da dupla ligação, antes do sufixo da palavra.
Aplicações dos alcenos
Os alcenos possuem muitas aplicações em indústrias. O mais importante é o Eteno (chamado também de etileno), uma molécula com dois átomos de carbono, responsável pelo amadurecimento de frutas. Além disso, é empregado como anestésico e, principalmente, na fabricação de polietileno, um plástico utilizado em brinquedos, sacolas plásticas, entre outros. Os demais alcenos são utilizados na fabricação de tecidos sintéticos, borrachas, corantes e, ainda, alguns explosivos.
Vídeos sobre a classe dos alcenos
Agora que vimos o conteúdo, vamos explorar alguns vídeos que ajudam na fixação e entendimento da matéria. Acompanhe a seguir nossa seleção:
Publicidade
Resumo do conteúdo
Nessa aula, temos um resumo de todo conteúdo para fixar melhor o que vimos até agora. Revise a fórmula geral desses compostos e como é feita nomenclatura. Aproveite para tirar todas as suas dúvidas!
Alcenos: definição e nomenclatura
De acordo com o que vimos, a nomenclatura dos alcenos segue os moldes dos hidrocarbonetos. Nesse vídeo, vamos ver um pouco mais sobre essa classe de compostos e também treinar a nomenclatura com bastante exemplos.
Mais exemplos de nomenclatura de alcenos
Para ficar craque na hora de nomear as moléculas, precisamos treinar. Nesse vídeo temos mais alguns exemplos de alcenos para fazer a nomenclatura.
Em conclusão, os hidrocarbonetos com insaturações em suas estruturas são chamados de alcenos, muito presentes no nosso cotidiano, principalmente na forma de plásticos de polietileno. Saiba mais sobre outras funções orgânicas importantes e não pare de estudar por aqui.
Referências
Química: a ciência central (1999) – Theodore L. Brown, Eugene H. LeMay, Bruce E. Bursten e Julia R. Burdge
Química Orgânica (1976) – T. W. Graham Solomons
Química Orgânica – Volume 1 (1987) – Paula Yurkanis Bruice

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Alcenos. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/alcenos. Acesso em: 02 de April de 2025.
1. [UFSC (adaptada)]
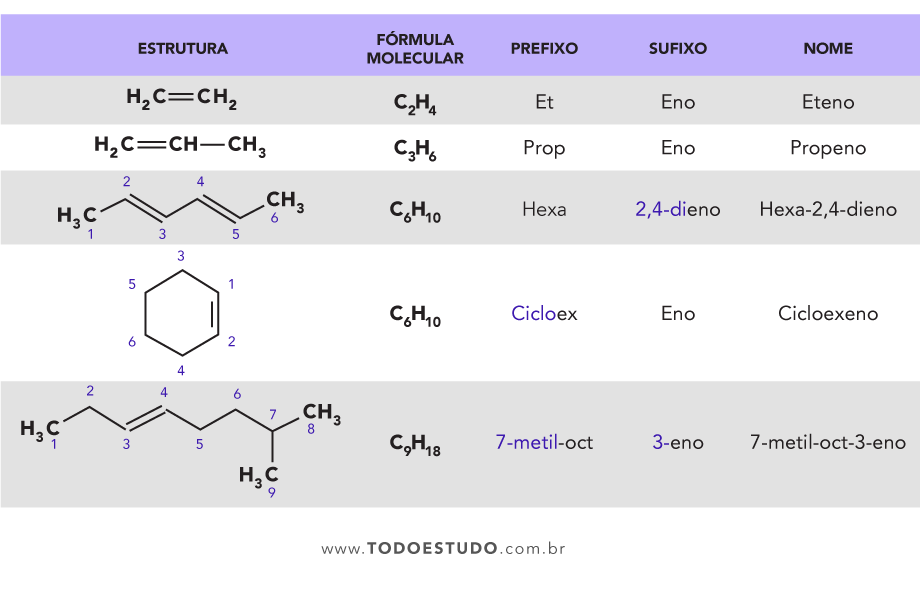
Observe as estruturas:
Os compostos I, II e III são, respectivamente:
a) 2-metil-3-etil-buteno, 2-etil-pent-2-eno, 2-metil-pent-3-eno.
b) 2,3-dimetil-pent-1-eno, 2-etil-pent-1-eno, 4-metil-pent-2-eno.
c) 2-etil-3-metil-but-3-eno, 2-metil-hex-3-eno, 4-metil-pent-2-eno.
d) 2,3-dimetil-pent-1-eno, 3-metil-hexano, 2-metil-pentano.
e) 2-metil-3-etil-but-1-eno, 2-etil-pent-1-eno, 2-metil-pent-2-eno.
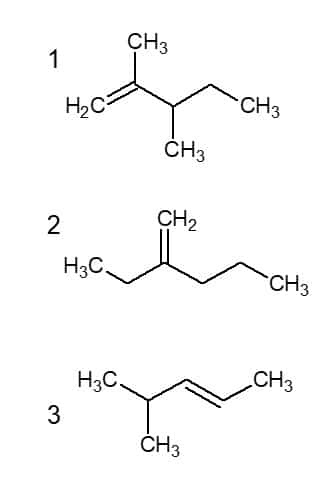
Na figura abaixo estão sinalizados os números dos carbonos e a cadeia principal de cada molécula.
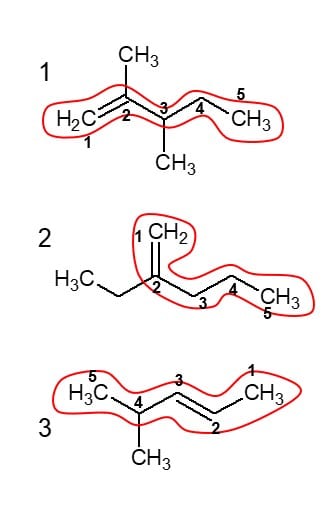
Na 1, a cadeia tem 5 carbonos, sendo que nos C2 e 3, existe ramificações de duas metilas. A dupla ligação está o C1. Então a molécula se chama 2,3-dimetil-pent-1-eno. Na 2, também com 5 carbonos, existe uma etila no carbono 2, portanto, 2-etil-pent-1-eno. Por fim, na 3, que também tem 5 carbonos na cadeia principal, no C4 existe uma metila e a dupla está no C2, logo 4-metil-pent-2-eno. Alternativa b
2.
Quais as fórmulas moleculares dos seguintes alcenos:
I – Eteno
II – 5-metil-hex-3-eno
III – Oct-6-eno
IV – Hepta-3,5-dieno
Para os compostos I, II e III, seguindo a regra de alcenos com uma insaturação (CnH2n):
I – Et = 2 carbonos, logo C2H4
II – hex = 6 carbonos + 1 metila, totalizando 7 carbonos. Então C7H14
III – oct = 8 carbonos, então C8H16
No último caso, um alcadieno tem fórmula geral de CnH2n-2, então:
Hept = 7 carbonos, C7H12