Chamamos de ponto de fusão e ponto de ebulição, respectivamente, as temperaturas nas quais os materiais passam do estado sólido para o estado líquido, e do estado líquido para o estado gasoso, ou ainda a temperatura máxima em que o determinado líquido pode manter-se em estado físico em uma determinada pressão.
Publicidade
Todos os elementos químicos da tabela periódica apresentam pontos de fusão e ebulição, que apresentam variações de acordo com os números atômicos. Podemos dizer, portanto, que ambos pontos são propriedades periódicas. No que se refere à tabela periódica, a ordem de crescimento das temperaturas de fusão e ebulição pode ser compreendido pelo esquema de setas demonstrado na imagem abaixo.
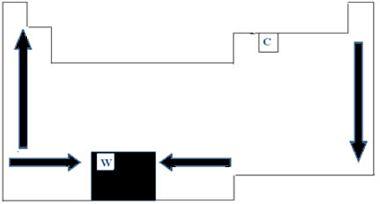
Ao observarmos os elementos que pertencem à mesma família do lado esquerdo da tabela, podemos notar que os pontos de fusão e ebulição acabam diminuindo de acordo com o aumento do número atômico do elemento, portanto, de baixo para cima. Do lado direito da tabela, o oposto acontece, sendo que o sentido de crescimento de pontos de fusão e ebulição de uma mesma família aumentam de cima para baixo. Os elementos que apresentam menores temperaturas, nesse caso, portanto, estão localizados na parte superior da tabela. Existe, entretanto, uma exceção, que é o carbono, com ponto de fusão de 3550°C e ebulição de 4287°C.
Os elementos que pertencem ao mesmo período da tabela, ou seja, mesma linha, podemos ver que os pontos de fusão e ebulição aumentam das laterais para o centro da tabela. O Tungstênio, por exemplo, é o elemento que fica ao centro da Tabela Periódica, apresentando, portanto, o maior ponto de fusão entre os metais, com valor igual a 3422°C. Justamente por isso, usa-se esse material para filamentos de lâmpadas incandescentes, já que não derreterá mesmo a altas temperaturas.
Ponto de fusão
Chamamos de ponto de fusão a temperatura em que uma determinada substância passa do estado sólido para o estado líquido. Nas substâncias puras, o processo de fusão acontece sempre a uma mesma temperatura que se manterá constante no decorrer de todo o processo. Mas na maioria das misturas de duas ou mais substâncias, essa constante não é verdadeira.
Ponto de ebulição
Chamamos de ponto de ebulição, ou ainda temperatura de ebulição, a temperatura em que uma dada substância passa do estado líquido para o estado gasoso. Para substâncias puras, o processo acontece sempre na mesma temperatura que se manterá constante no decorrer de todo o processo. A grande maioria, entretanto, das misturas de duas ou mais substâncias, apresenta mudanças nas temperaturas que variam no decorrer do processo.
Publicidade
Referências
Química para o ensino médio – EF Mortimer, AH Machado

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Ponto de fusão e ebulição. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/ponto-de-fusao-e-ebulicao. Acesso em: 10 de April de 2025.
01. [ENEM] A tabela a seguir traz os pontos de fusão e ebulição, em ºC, sob pressão de 1 atm, de alguns materiais. Com base nas informações da tabela, assinale a alternativa que indica quais materiais estão no estado de agregação líquido à temperatura ambiente (cerca de 25ºC):
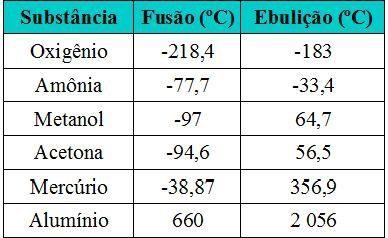
a) Oxigênio e Metanol
b) Metanol, acetona e mercúrio
c) Metanol e mercúrio
d) Amônia, acetona, mercúrio e alumínio
e) Nenhuma das alternativas.
02. [ENEM] O ponto de fusão do cobre é igual a 1083 ºC e o ponto de ebulição é de 2 310 ºC. Assinale a alternativa que indica corretamente o estado físico do cobre em 20ºC, 100ºC, 1000ºC e 2500ºC, respectivamente:
a) sólido, sólido, líquido, gasoso.
b) Sólido, sólido, sólido, sólido.
c) Sólido, sólido, sólido, gasoso.
d) Sólido, sólido, sólido, líquido.
e) Sólido, líquido, líquido, gasoso.
01. [B]
02. [C]