A natureza das ligações entre átomos de não metais sempre foi motivo de discussão na química, já que não formam cátions monoatômicos. Pensando nisso, no início do século XX, o químico norte-americano Gilbert Newton Lewis propôs um modelo que explica essas ligações covalentes, chamado estrutura de Lewis. Confira abaixo como representar essa estrutura, além de exemplos e exercícios resolvidos.
Publicidade
O que é estrutura de Lewis?
Lewis propôs o conceito das ligações covalentes, em que um par de elétrons é compartilhado entre dois átomos. O modelo desenvolvido por ele consiste na representação das ligações covalentes em uma molécula ou íon por traços que conectam dois elementos (ou seja, o par de elétrons compartilhado) e pontos representando os outros elétrons da camada de valência.
Relacionadas
Primeiramente, é preciso entender o que é a camada de valência (C.V.). Ela representa a camada eletrônica mais externa de um átomo, com os elétrons disponíveis para a realização das ligações covalentes.
De modo geral, sabemos a quantidade de elétrons na C.V. dos átomos olhando para suas respectivas famílias na tabela periódica. Os elementos da família 1A, como o hidrogênio, possuem 1 elétron de valência. Os elementos da família 5A, como o nitrogênio, possuem 5, e assim por diante.
A regra do octeto
Para que as ligações sejam formadas e a estrutura de Lewis seja obtida, o químico propôs a regra do octeto. Essa regra básica implica que os átomos tendem a ganhar estabilidade eletrônica ao atingirem configuração de gás nobre (os elementos da família 8A).
Isso significa que os átomos tendem sempre a adquirir 8 elétrons na camada de valência. Há exceções, como é o caso do hidrogênio. Esse só possui um orbital eletrônico, portanto seu octeto é alcançado com dois elétrons de valência (como o Hélio).
Publicidade
Como fazer a estrutura de Lewis
Sabendo disso, então, pode-se representar as estruturas moleculares de compostos partindo de suas fórmulas químicas. Porém, para isso, deve-se seguir algumas regras.
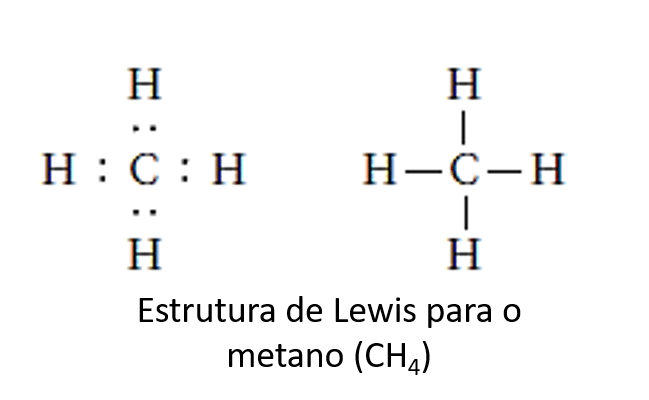
Regras para a estrutura de Lewis
- Regra do octeto: todos os elementos da molécula devem obedecer à regra do octeto e possuir seus 8 elétrons de valência.
- Átomos centrais: geralmente, as moléculas simples possuem um elemento diferente dos demais. Esse é o átomo central. Já em moléculas mais complexas, o elemento menos eletronegativo é tido como central, com os demais ao seu redor.
- Simetria entre os átomos: a estrutura de Lewis é mais facilmente obtida quando os elementos são distribuídos simetricamente ao redor do átomo central.
- Átomos terminais: os halogênios, por já possuírem 7 elétrons de valência, só podem realizar uma ligação e, portanto, são átomos terminais em moléculas (exceto quando em oxiácidos). O hidrogênio sempre é terminal.
- Distribuição dos elétrons: primeiro deve-se adicionar os elétrons compartilhados entre os átomos que realizam as ligações covalentes e, em seguida, distribuir entre os outros elementos.
Sabendo dessas regras gerais, é possível seguir uma série de passos que permite a aquisição da estrutura de Lewis para os compostos que realizam ligações covalentes.
Publicidade
Estruturas de Lewis com ligações covalentes
- Contar os elétrons de valência da molécula de acordo com a família em que cada elemento se encontra na tabela periódica. Por exemplo, o carbono tem 4 elétrons de valência (E.V.) por ser da família 4A. Já o oxigênio (família 6A) tem 6 E.V. e assim por diante.
- Organizar os elementos em um arranjo mais provável, seguindo as regras gerais citadas anteriormente.
- Colocar um par de elétrons entre uma dupla de elementos. Serão os elétrons compartilhados. Para saber a quantidade, basta dividir o número total de E.V. por 2.
- Completar o octeto de todos os átomos (dupleto no caso do hidrogênio) com os elétrons remanescentes.
- Representar as ligações covalentes com traços nos lugares dos elétrons compartilhados.
No início, pode ser difícil prever a posição de cada átomo. Mas, com o tempo, você vai adquirir prática e passará a representar as estruturas com mais facilidade.
Estruturas de Lewis com íons
Para moléculas iônicas, o mesmo procedimento demonstrado anteriormente é utilizado. A diferença é que é preciso adicionar ou subtrair elétrons do valor total de E.V..
Nas moléculas com carga positiva, subtrai-se o valor correspondente à carga dos elétrons de valência, uma vez que a carga positiva indica uma deficiência ou falta de elétrons. Já para as moléculas com carga negativa, portanto, adiciona-se o valor da carga ao número total de E.V., já que há uma sobra de elétrons na molécula.
Exemplos
Agora, seguindo os passos apresentados, é possível representar as moléculas como estrutura de Lewis. Acompanhe:
Água (H2O)
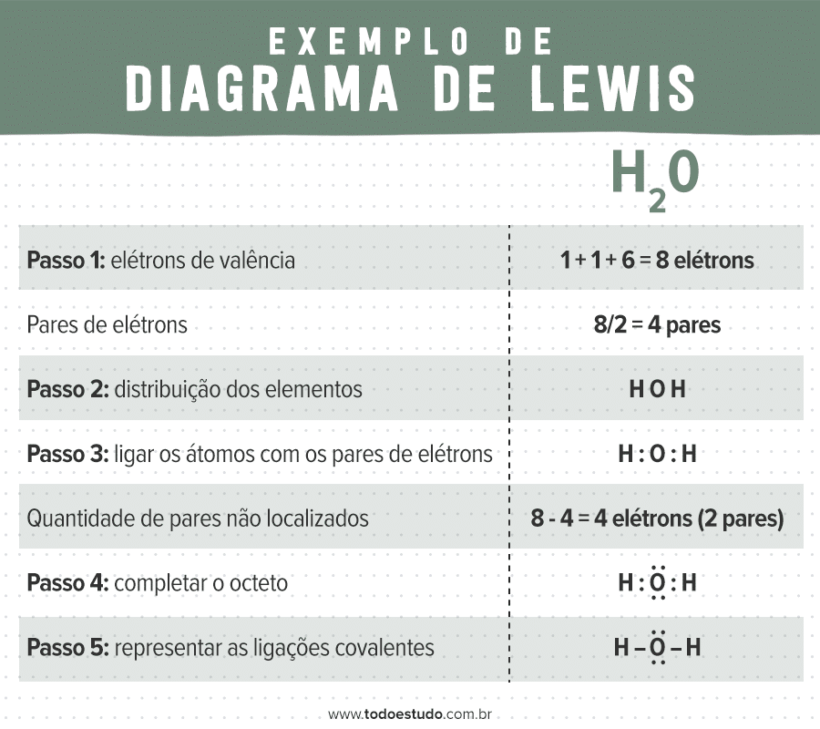
Primeiro, calculamos o número total de elétrons de valência da molécula. O hidrogênio é da família 1A, portanto tem 1 elétron, e o oxigênio (familía 6A) tem 6 elétrons. A soma dos dois átomos de hidrogênio e um de oxigênio resulta em 8 elétrons de valência da molécula, portanto 4 pares eletrônicos.
Depois de distribuir os átomos de forma simétrica e indicar a formação das ligações com um par eletrônico entre os elementos, ficamos agora com 4 elétrons não compartilhados. Estes devem ser distribuídos na molécula de forma a completar o octeto do oxigênio, uma vez que o dupleto do hidrogênio já está completo. Assim, podemos representar as ligações covalentes com um traço, finalizando a estrutura de Lewis da água.
Amônia (NH3)
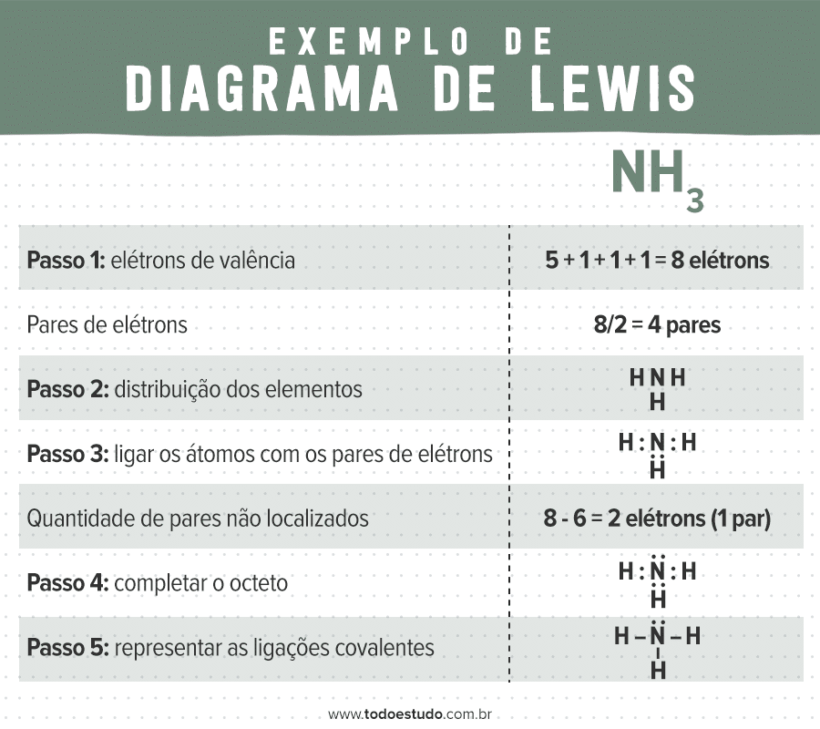
Nitrogênio tem 5 elétrons de valência (família 5A), portanto a molécula tem um total de 8 elétrons de valência, assim como a água. A distribuição é realizada de maneira semelhante à anterior, restando apenas um par eletrônico não compartilhado, que é adicionado ao átomo de nitrogênio, completando seu octeto.
Íon clorito (ClO2–)

O íon clorito possui uma carga negativa, que deve ser levada em consideração no cálculo dos elétrons de valência. Assim, como o cloro possui 7 E.V. e os átomos de oxigênio, 6 cada um, a molécula tem, ao todo, 19 elétrons dos elementos e um elétron da carga negativa. Ou seja, 20 elétrons que serão distribuídos entre ligações e pares não compartilhados.
Para completar o octeto dos átomos, devemos começar pelo cloro, já que ele é o mais eletronegativo. Depois de completo, representamos as ligações covalentes e indicamos a carga geral da molécula de -1, pelo elétron adicional que colocamos.
Íon formiato (HCO2–)
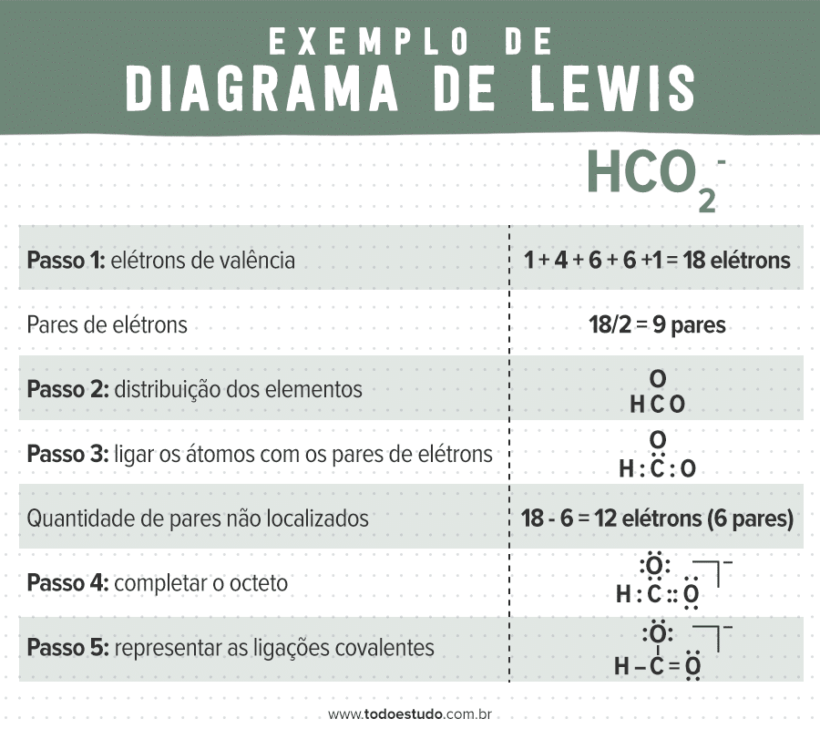
Para o íon formiato, realizamos da mesma forma. Mas, aqui, é importante ressaltar que, na hora de completar o octeto, o carbono não é um átomo tão eletronegativo quanto o oxigênio, por exemplo. Por conta disso, ele não tem capacidade de acomodar pares de elétrons desemparelhados, portanto o octeto se completa com a formação de ligação dupla entre ele e um dos oxigênios.
Vimos, nesses exemplos, que, ao seguirmos o passo a passo, conseguimos fazer uma estrutura de Lewis de maneira rápida. Com o treino, a montagem passa a ser mais simples e podemos até prever a simetria molecular das estruturas.
Vídeos sobre a fórmula eletrônica de Lewis
Que tal conferir agora alguns vídeos que ajudam a compreender melhor o conteúdo? Veja abaixo:
Passo a passo para montar as estruturas de Lewis
Nesse primeiro vídeo, é apresentado, de uma maneira mais visual, como podemos seguir os passos até montarmos uma estrutura de Lewis da maneira correta.
Exercícios de vestibulares
Com as resoluções desses exercícios que já caíram em vestibulares e no ENEM, é possível ter um maior entendimento do conteúdo. Confira!
Resumo e exceções
Nesse último vídeo, você verá o conteúdo de uma forma resumida, que ajuda a fixar tudo o que foi visto até agora. Veja também exceções bastante cobradas em vestibulares e no ENEM.
Agora, você é capaz de representar as estruturas que possuem ligações covalentes do modo que foi proposto por Lewis, completando o octeto eletrônico de cada átomo. Lembre-se de que a prática contínua traz mais facilidade no desenho de estruturas químicas. Não pare de estudar por aqui: veja também sobre a regra do octeto de modo mais aprofundado.
Referências
Princípios de química: questionando a vida moderna e o meio ambiente (2018) – Peter Atkins e Loretta Jones

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Estrutura de Lewis. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/estrutura-de-lewis. Acesso em: 02 de April de 2025.
1. [Vunesp-SP (adaptado)]
Dado o valor de elétrons da camada de valência dos seguintes átomos:
C – 4 elétrons, P – 5 elétrons, O – 6 elétrons, F e Cl – 7 elétrons
Represente a estrutura de Lewis de: P e Cℓ têm, respectivamente, 5 e 7 elétrons na camada de valência.
Tetracloreto de carbono
Tricloreto de fósforo
Íon carbonato (CO32-)
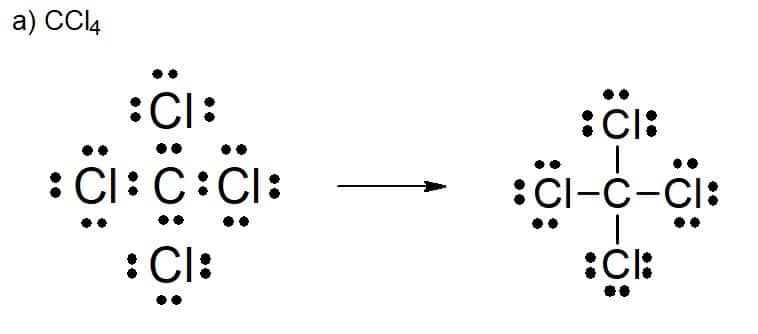
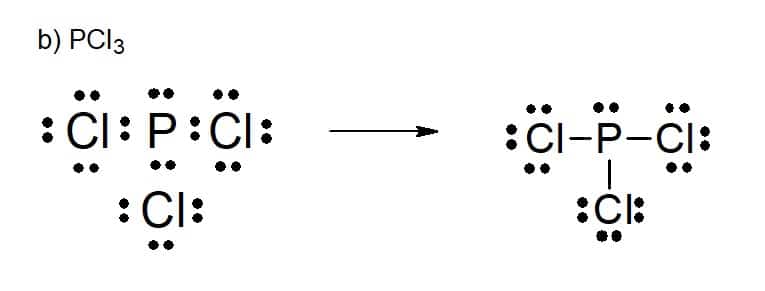
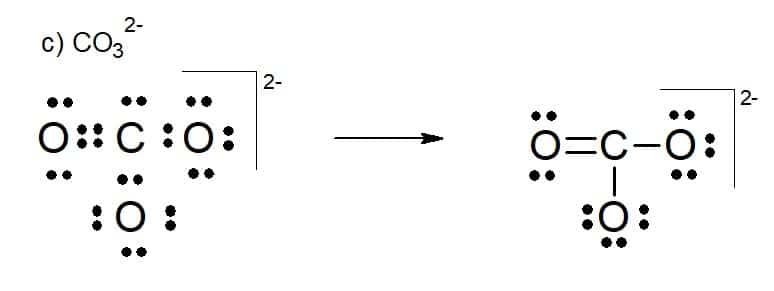
2. [PUC-SP (adaptado)]
Indique se a afirmação é verdadeira ou falsa.
a) Se há diferença de eletronegatividade entre dois átomos, então o mais eletronegativo deve ser o átomo central da estrutura.
b) Uma ligação covalente formada pelo compartilhamento de dois elétrons é chamada ligação dupla.
c) Na molécula de hidrogênio (H2), o par de elétrons compartilhados completa a camada de valência de cada hidrogênio.
d) Na molécula de CH4, cada hidrogênio tem uma configuração eletrônica como a do hélio, e o carbono tem uma configuração eletrônica como a do neônio.
a) FALSA. O elemento central deve ser o MENOS eletronegativo.
b) FALSA. A ligação dupla é caracterizada pelo compartilhamento de 4 elétrons (dois pares).
c) VERDADEIRA.
d) VERDADEIRA. O hélio possui dois elétrons de valência, assim como o hidrogênio nessa molécula, e o neônio possui 8, como o carbono.