A palavra molar, vem de molécula, que significa o conjunto de átomos que se ligam por meio das ligações químicas. A massa de uma molécula pode ser calculada por meio da soma das massas atômicas dos átomos que formam essa molécula, e seu resultado é conhecido pelo nome de massa molecular. Ao calcularmos, por exemplo, a massa molecular do gás sulfídrico, representado por H2S, precisamos saber qual é a massa atômica de cada um dos átomos, e isso pode ser encontrado por meio da tabela periódica.
Publicidade
Analisando a tabela, temos que H = 1 u.m.a. (unidade por massa atômica), e S = 32,1 u.m.a. A massa molecular será a soma da massa atômica dos átomos, mas é preciso estar atento ao coeficiente que, no caso do hidrogênio, nesta fórmula, é igual a 2. Nesse caso, multiplicamos sua massa por 2.
H2S = 1 . 2 + 32,1 = 34,1 u
A massa molar, mor sua vez, assim como o número de mols de uma molécula, está relacionado à constante de Avogadro (6,02 x 10²³). O número de entidades elementares, segundo o conceito, contidas em 1 mol, correspondem à constante de Avogadro, que possui o valor de 6,02 x 10²³ mol-1. Com isso temos que a massa molar é igual a massa de 6,02 x 10²³ entidades químicas expressas em g/mol. Por exemplo, em H2S, temos que a massa molecular é igual a 34,1 u, enquanto a massa molar é igual a 34,1 g/mol.
Isso significa que em cada 34,1 g/mol de Gás Sulfídrico, encontramos 6,02 x 10²³ moléculas, ou ainda 1 mol de moléculas de gás sulfídrico. Com isso, podemos concluir que o que difere a massa molecular e a massa molar, são as unidades de medida. A massa molar está relacionada ao número de mols que é dado pela Constante de Avogadro.
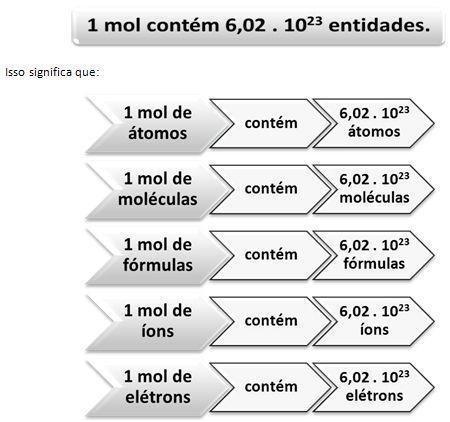
Mol, portanto, é a quantidade de matéria de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 kg de carbono-12, segundo o conceito introduzido por Wilhelm Ostwald, químico alemão no ano de 1826. Chamamos de mol a unidade, mas também o símbolo da unidade da quantidade de matéria.
Publicidade
Referências
Química para o ensino médio – EF Mortimer, AH Machado
Constante de Equilíbrio – E Químico

Por Natália Petrin
Formada em Publicidade e Propaganda. Atualmente advogada com pós-graduação em Lei Geral de Proteção de Dados e Direito Processual Penal. Mestranda em Criminologia.
Petrin, Natália. Número de mol. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/numero-de-mol. Acesso em: 06 de April de 2025.
01. [UNB] Os microprocessadores atuais são muito pequenos e substituíram enormes placas contendo inúmeras válvulas. Eles são organizados de forma que apresentem determinadas respostas ao serem percorridos por um impulso elétrico. Só é possível a construção de dispositivos tão pequenos devido ao diminuto tamanho dos átomos. Sendo estes muito pequenos, é impossível contá-los. A constante de Avogadro – e não o número de Avogadro – permite que se calcule o número de entidades – átomos, moléculas, formas unitárias, etc. – presentes em uma dada amostra de substância. O valor dessa constante, medido experimentalmente, é igual a 6,02 . 1023 mol-1. Com relação ao assunto, julgue os seguintes itens.
(01) A constante de Avogadro é uma grandeza, sendo, portanto, um número (6,02 . 1023) multiplicado por uma unidade de medida (mol-1).
(02) A constante de Avogadro, por ser uma grandeza determinada experimentalmente, pode ter seu valor alterado em função do avanço tecnológico.
(03) Massas iguais de diferentes elementos químicos contêm o mesmo número de átomos.
(04) Entre os elementos químicos, o único que, em princípio, não está sujeito a uma variação de massa atômica é o isótopo do carbono de massa 12,00 u.
02. [Fuvest-SP] A tabela abaixo apresenta o mol, em gramas, de várias substâncias:
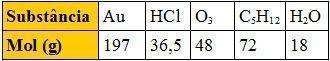
Comparando massas iguais dessas substâncias, a que apresenta maior número de moléculas é:
a) Au
b) HCl
c) O3
d) C5H10
e) H2O
01. [(01) Verdadeiro.
(02) Verdadeiro.
(03) Falso. Os átomos de diferentes elementos químicos possuem massas atômicas diferentes. Assim, se pegarmos massas iguais de diferentes elementos químicos, o número de átomos de cada elemento químico nessas massas será diferente (comparando massas iguais, quanto menor a massa atômica do elemento, maior o número de átomos desse elemento nessa massa).
(04) Verdadeiro.]
02. [E]