O hidrogênio é um elemento químico com número atômico 1, representado pela letra H na tabela periódica. Sua massa atômica é de aproximadamente 1,0 u, de forma que caracteriza o elemento como o mais leve de todos. Apresenta-se, normalmente, em sua forma molecular gasosa (H2). Possui propriedades distintas e não se encaixa em nenhum grupo da tabela periódica.
Publicidade
A história do hidrogênio
Segundo a teoria de Alpher-Bethe-Gamov, o hidrogênio surgiu no início da formação do universo que, com a expansão provocada pelo Big Bang, houve uma aproximação de elétrons e prótons suficiente para que estes se ligassem formando átomos a partir de átomos de Hidrogênio, bem como Hélio e Lítio.
Relacionadas
Como dito, a forma mais comum de se encontrar o elemento é em sua forma molecular (H2). Sua descoberta ainda é motivo de discussão científica, já que muitos pensadores históricos clamam seu reconhecimento. De modo geral, entretanto, as descobertas foram realizadas de maneira similar com a mistura de metais com ácidos fortes, onde ocorria a liberação de um gás inflamável em uma reação de simples-troca.
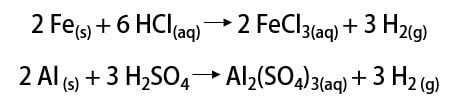
A partir de então, o gás passou a ser utilizado em diversas aplicações, desde em combustíveis de foguetes, na indústria alimentícia, na transformação de gorduras em óleos vegetais, nas gorduras hidrogenadas até em balões dirigíveis nos séculos XIX e XX (onde o gás, mais leve que o ar atmosférico, promovia a subida do meio de transporte).

Publicidade
Fórmula
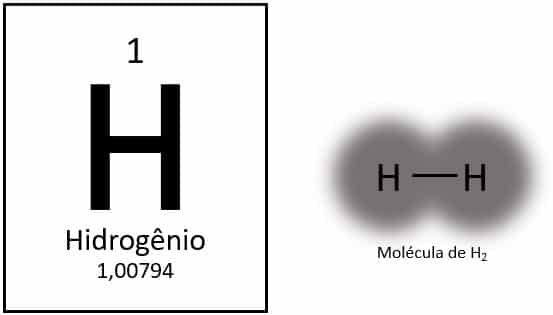
O hidrogênio é o elemento mais leve da tabela periódica, com massa atômica de aproximadamente 1,0 u. Com número atômico (Z) igual a 1, o elemento não possui um grupo definido na tabela. É classificado como elemento solitário, mas é geralmente apresentado como um membro especial da família 1A por conta de sua configuração eletrônica (1s1), com um elétron na camada de valência.
Em condições normais, o hidrogênio é encontrado em sua forma molecular gasosa, quando dois átomos se ligam e formam o gás hidrogênio (H2).
Publicidade
Características
Veremos, agora, algumas características que fazem do hidrogênio um elemento especial:
- O hidrogênio possui ponto de fusão de -259,2 °C e de ebulição de -252,9 °C, temperaturas muito abaixo do ambiente, comprovando, então, o fato de ser um gás;
- O H2, por ser uma molécula diatômica com dois átomos idênticos, é apolar, ou seja, não apresenta diferença de densidade eletrônica;
- Também pode, por conta da apolaridade, interagir com outras moléculas de hidrogênio por meio de interações de dipolo-induzido;
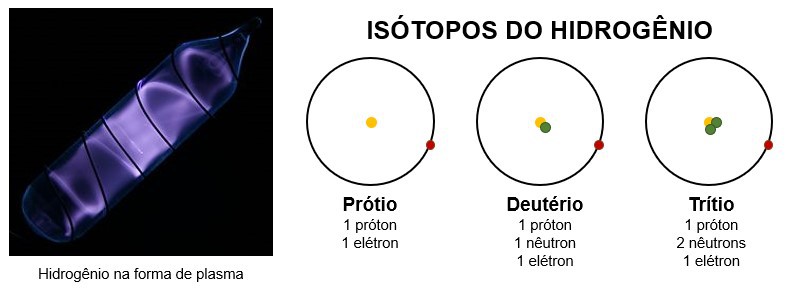
- É um gás incolor, porém, em sua forma de plasma (sob alta energia), é um gás com brilho roxo;
- É insolúvel em água;
- Possui três isótopos principais: o prótio, o deutério e o trítio.
O hidrogênio é motivo de muito estudo na área de química. Está presente em diversas reações e moléculas orgânicas. Trata-se do átomo mais simples e fundamental para o entendimento da teoria quântica, entre outras áreas, mas como ele é formado? Vamos ver a seguir.
Como é formado o hidrogênio
Existem algumas maneiras de se obter o gás hidrogênio, entre as quais é possível citar a maneira industrial e a maneira laboratorial. De modo industrial, como é preparado em grande escala, a forma mais econômica encontrada é da remoção de hidrogênio de hidrocarbonetos, pela oxidação catalítica de gás natural (metano), que em altas temperaturas (de cerca de 700-1100 °C) reage com vapor de água, produzindo monóxido de carbono (CO) e o H2.
![]()
Já no laboratório, em contrapartida, o gás hidrogênio é preparado de maneira mais simples, pela reação de metais, normalmente o zinco, com ácidos fortes, em uma reação de dupla-troca.
![]()
Para que serve o hidrogênio
Ele possui diversas aplicações industriais que compreendem desde a produção de semicondutores até a indústria petroquímica. Diversas indústrias investem em pesquisas que buscam transformar o gás H2 em um combustível alternativo viável, diminuindo, assim, os efeitos poluentes dos combustíveis que utilizamos hoje em dia. O maior consumo de H2 é por conta de indústrias que utilizam para a fabricação de amônia. No nosso organismo, o elemento em sua forma catiônica (H+) é responsável pela acidez e pelo gradiente de potencial em algumas regiões celulares que favorece a formação de ATP nas células, nossa fonte de energia.
Vídeos sobre o hidrogênio
Agora que aprendemos tudo isso, veremos, então, alguns vídeos que nos ajudarão a compreender ainda mais o hidrogênio.
Quem é o hidrogênio
Neste vídeo, temos um apanhado geral sobre o elemento químico mais simples da tabela periódica.
Hidrogênio e suas características
Aqui, de forma simples, somos apresentados a algumas características do hidrogênio que fazem desse elemento tão simples, algo tão fascinante.
Afinal, em qual família o hidrogênio se enquadra
Vimos que o átomo de H não possui um grupo definido na tabela periódica, mas será que ele pode se encaixar em mais de uma família? Vamos descobrir neste vídeo.
Em conclusão, vimos a grande importância que um elemento teoricamente tão simples que há no universo. O hidrogênio é muito estudado e sempre foi o foco de muitas discussões dos primeiros pensadores da ciência. Não pare seus estudos aqui, veja mais sobre as ligações de hidrogênio conhecendo as Forças Intermoleculares.
Referências
Alpher, R. A., H. Bethe and G. Gamow. “The Origin of Chemical Elements,” Physical Review, 73 (1948), 803
Jeremy M. BERG, John L. TYMOCZKO, Lubert STRYER. Bioquímica. Tradução por Antonio José Magalhães da Silva Moreira. 7. ed. Rio de Janeiro: Guanabara Koogan, 2014.
ATKINS, P.W., Jones, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5ª edição. Porto Alegre: Ed. Bookman, 2012.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Hidrogênio. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/hidrogenio. Acesso em: 01 de April de 2025.
1.
Sobre as características do hidrogênio elementar e molecular, indique se as afirmações a seguir são Verdadeiras ou Falsas e correlacione com a alternativa correta.
( ) Em temperatura ambiente, o hidrogênio molecular é encontrado na forma sólida
( ) Na natureza, é fácil encontrar hidrogênio elementar.
( ) A massa molar da molécula de gás hidrogênio é de 2 g/mol, sendo o gás mais leve da natureza.
( ) A geometria da molécula de hidrogênio é linear.
( ) O gás hidrogênio é dificilmente inflamável.
( ) O átomo de hidrogênio possui um elétron na camada de valência
A alternativa correspondente às propriedades é:
A ) F – F – F – V – V – V
B ) F – V – F – V – F – V
C ) V – F – F – F – F – V
D ) V – F – V – V – F – F
E ) F – F – V – V – F – V
Analisando as alternativas em ordem temos:
1- Falsa, o hidrogênio molecular é encontrado somente na forma gasosa em temperatura ambiente;
2- Falsa, ele não é encontrado em sua forma elementar (atômica);
3- Verdadeira, a molécula de H2 possui dois átomos de hidrogênio, cada qual com massa molecular de 1 g/mol;
4- Verdadeira, moléculas diatômicas são sempre lineares;
5- Falsa, o gás H2 é altamente inflamável;
6- Verdadeira, possui apenas um elétron.
Portanto, a alternativa correta é a letra E ) F – F – V – V – F – V.
2.
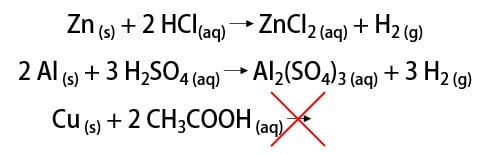
Complete as lacunas das reações de metais com ácidos abaixo, indicando se há ou não reação de formação de gás hidrogênio.
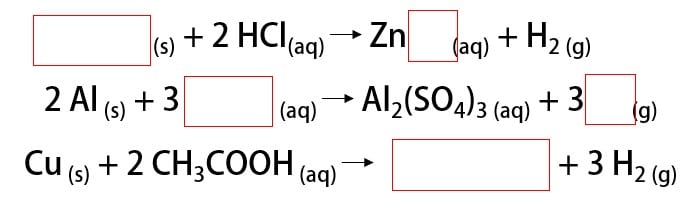
A primeira reação ocorre porque o metal reage com o ácido clorídrico, que é forte. O produto é o gás hidrogênio e o cloreto de zinco (ZnCl2), uma vez que é uma reação de dupla-troca. Dessa forma é possível dizer que o metal dos reagentes era o zinco.
Na segunda reação, o alumínio precisa reagir com um ácido forte para que a reação ocorra. Como produto, temos o sulfato de alumínio (Al2(SO4)3). Para que a dupla-troca seja feita, o ácido deve conter o ânion sulfato (SO4). O único ácido forte que o contém é o ácido sulfúrico (H2SO4).
Na última reação cobre está reagindo com o ácido acético. Este, por sua vez, é um ácido fraco. Portanto essa reação de formação do gás hidrogênio não ocorre.