A Lei de Proust foi elaborada pelo químico francês Joseph Louis Proust, em 1794.
Publicidade
Também conhecida como Lei das Proporções Definidas ou Constantes, esta lei postula que a quantidade de matéria dos reagentes e a quantidade de matéria dos produtos que participam de uma reação obedecem sempre a uma proporção fixa e definida.
Os experimentos de Proust
Ao realizar experimentos com substâncias puras, Proust observou que, independentemente do processo utilizado para obtê-las, a composição em massa dos elementos era constante.
O químico francês averiguou que as massas dos reagentes e as massas dos produtos que participavam da reação obedecem sempre a uma proporção constante.
Por exemplo, em uma reação entre hidrogênio e oxigênio formando água, podem ser obtidos os seguintes valores experimentais:
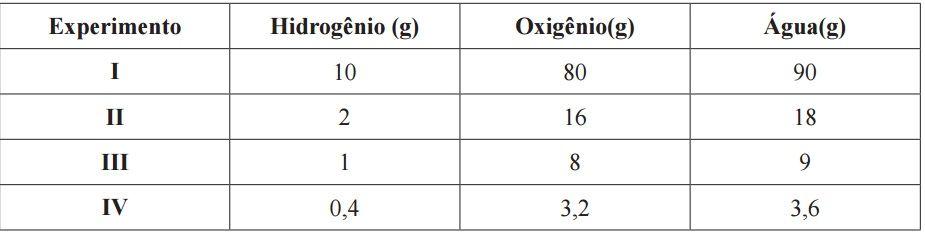
Ao analisarmos a tabela acima, podemos observar que qualquer amostra de água sempre apresenta 88,9% de oxigênio e 11,1% em massa de hidrogênio combinados na mesma proporção constante (1/8 em massa de hidrogênio e oxigênio).
Podemos observar ainda que, para cada reação, a massa do produto é igual à soma da massa dos reagentes, princípio que vai ao encontro da Lei de Lavoisier.
Publicidade
Na época em que os experimentos foram realizados, os cientistas não tinham acesso a aparelhos modernos de pesagem. Naquele tempo, as balanças existentes permitiam obter um peso não muito preciso, mas que colaborou para os conceitos utilizados até os dias atuais.
A Lei de Proust não foi imediatamente aceita pelos químicos. Vlaude-Louis Berthollet foi um contestador fervoroso das ideias de Proust, no entanto, posteriormente admitiu que o químico francês tinha razão.
Devido à polêmica em torno do trabalho, a lei foi aceita somente no ano de 1811, quando o químico sueco Jöns Jacop Berzellius reconheceu a validade das ideias de Proust.
A Lei de Proust é assim enunciada:
Publicidade
“Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa”.
A importância da Lei de Proust
A Lei de Proust é uma das Leis Ponderais, que são aquelas que demonstram relações entre as massas dos elementos participantes das reações químicas.
Preste bastante atenção no exemplo da água:
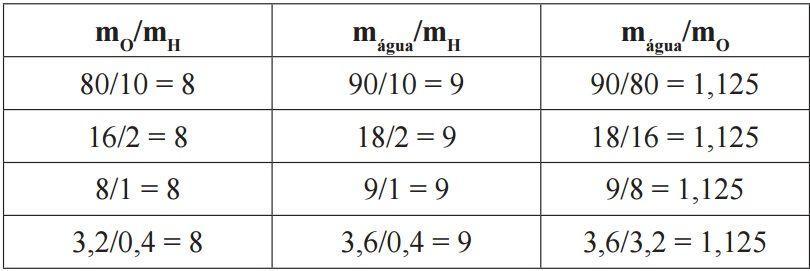
A lei postulada por Proust é a base da teoria atômica de John Dalton, que a corrobora. Os experimentos do químico francês foram essenciais para a aceitação internacional das pesquisas posteriores de Dalton, e a sua lei foi estendida a qualquer reação química.
Referências
Lei de Proust. Disponível em: http://www.acervodigital.unesp.br/
Joseph Louis Proust. Disponível em: http://web.ccead.puc-rio.br/

Por Débora Silva
Formada em Letras (Licenciatura em Língua Portuguesa e suas Literaturas) pela Universidade Federal de São João del-Rei (UFSJ), com certificado DELE (Diploma de Español como Lengua Extranjera. Produz conteúdo web, abrangendo diversos temas, e realiza trabalhos de tradução e versão em Português-Espanhol.
Silva, Débora. Lei de Proust. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/lei-de-proust. Acesso em: 03 de April de 2025.
1. [UEL-PR] 46,0 g de sódio reagem com 32,0 g de oxigênio formando peróxido de sódio. Quantos gramas de sódio serão necessários para obter 156 g de peróxido de sódio?
a) 23,0
b) 32,0
c) 69,0
d) 78,0
e) 92,0
2. [UESPI] Qualquer que seja a procedência ou processo de preparação do NaCl, podemos afirmar que sua composição é sempre 39,32% de sódio e 60,68% de cloro, com base na lei de:
a) Lavoisier
b) Dalton
c) Proust
d) Richter
e) Avogadro
1. [E]
2. [C]