Já parou para pensar por que um parafuso afunda quando colocado dentro de um copo d’água? A resposta é bem óbvia: o parafuso é mais pesado e afunda. Entretanto, e se colocarmos um cubo de gelo dentro deste copo, por que ele boia? É aí que entra a densidade, uma grandeza muito útil na identificação de compostos.
Publicidade
O que é densidade?
A densidade, também chamada de massa volumétrica, de uma substância é equivalente à sua massa por unidade de volume. Isto é, trata-se da razão entre a massa da substância pelo espaço que ela ocupa. É simbolizada pela letra grega ρ (RO), ou simplesmente por D e é medida, no Sistema Internacional de Unidades (SI), em kg/m3. Ela pode ser facilmente calculada pela equação:
Relacionadas
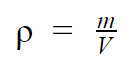
Em que,
- ρ: densidade, em kg/m3;
- m: massa da substância, em kg;
- V: volume da substância, em m3.
Apesar de ser expressa em kg/m3, de acordo com o SI, a densidade é comumente representada pela unidade de g/cm3 para os líquidos e sólidos (1 cm3 é equivalente a 1 mL). Já para os gases, a unidade mais comum é a de g/L.
Como pode ser visto pela equação, a densidade é diretamente proporcional à massa da substância, ou seja, quanto maior a massa de um composto, maior é sua densidade. A grandeza também é inversamente proporcional ao volume, indicando que quanto maior for o volume de um composto, menor é sua densidade. É por isso que o gelo bóia na água.
O gelo é a água solidificada. Ao passar pelo processo de fusão, ou seja, do estado líquido para o sólido, a água se expande significativamente (é o único líquido que se expande ao solidificar; os demais líquidos se contraem em condições semelhantes). Esta expansão é suficiente para aumentar o volume do cubo de gelo em relação à mesma quantidade (em massa) no estado líquido. Como volume e densidade são grandezas inversamente proporcionais, o maior volume do cubo de gelo faz com que ele tenha menor densidade que a água líquida e, por isso, ele flutua no copo.
Publicidade
Fatores que afetam
- Temperatura: com exceção da água, quando uma substância – seja esta sólida ou líquida – é aquecida, ela sofre uma dilatação volumétrica. Sendo assim, sua densidade varia, se tornando menor do que quando o mesmo material está em uma temperatura menor.
- Pressão: quando gases sofrem alteração de pressão, seu volume é facilmente alterado. Portanto, além de depender da temperatura, a densidade dos gases depende também da pressão a quais estão submetidos.
Como vimos, toda variação de temperatura e pressão é suficiente para alterar a densidade de determinada substância. Por conta disso, uma maneira que os cientistas encontraram para “padronizar” estes valores, transformando-os em constantes que são utilizadas na identificação das substâncias. Assim, estabeleceu-se o valor exato da densidade em condições normais de temperatura e pressão (CNTP), ou seja, à 25ºC de temperatura e sob pressão de 1 atm.
Desta maneira, tendo dois copos com o exatamente o mesmo volume em ambos e nas CNTP, um de água e outro de álcool, é possível diferenciar um do outro pela diferença de densidade. O que for menos denso corresponde ao copo com álcool.
Densidade absoluta X Densidade relativa
Densidade absoluta é justamente o que vimos até agora, ou seja, a relação entre massa e volume dada pela letra grega ρ. Ela é intrínseca a uma substância. Já a densidade relativa é a razão entre a densidade absoluta de uma substância e a densidade absoluta de outra tomada como padrão.
Publicidade
Geralmente, a água à 4°C é escolhida por conta de sua densidade ser exatamente 1 kg/m3. Portanto, a densidade relativa é adimensional devido ao quociente. Quando se diz que um material tem densidade relativa de 3, queremos dizer que ele é 3 vezes mais denso que a água.
Densidade de materiais
Como vimos, podemos caracterizar as substâncias de acordo com o valor de suas densidades em condições de temperatura e pressão determinadas. A título de curiosidade, vamos ver a densidade de alguns compostos, em g/cm3, na tabela:
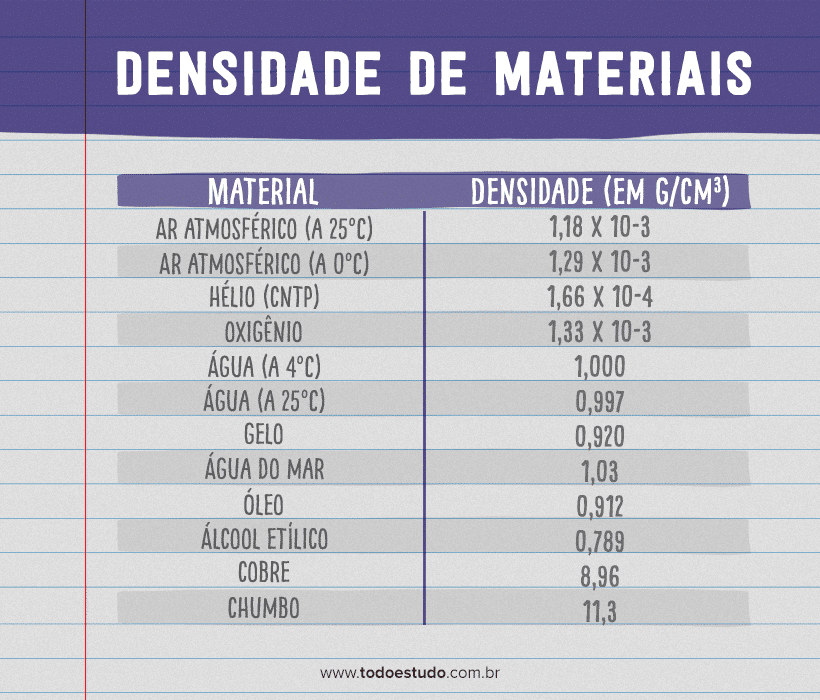
Percebemos, então, que o gelo realmente flutua na água por ter menor densidade, assim como o óleo. Já o mercúrio, metal que é líquido à temperatura ambiente, é muito mais denso que a água (quase 14 vezes mais denso) e o cobre, fazendo com que o cobre flutue no mercúrio.

Vídeos sobre densidade
Vamos conferir agora alguns vídeos sobre a matéria para entendermos melhor sobre os conceitos envolvidos.
Experiência da ampulheta líquida
Este vídeo mostra uma maneira divertida de apresentar a diferença de densidade entre água e óleo com uma experiência fácil de fazer em casa.
Aulão para entender de vez o que é a densidade
Neste vídeo, há a aula mais completa sobre o tema com experimentos para facilitar no entendimento do conteúdo.
Exercícios de densidade
Neste vídeo, temos a resolução de alguns exercícios que envolvem a densidade.
O conceito de densidade é muito importante no cotidiano. Como no caso do controle de qualidade de combustíveis onde, por meio da densidade do etanol, é possível checar se houve alguma adulteração no produto pela adição de água. Não pare seus estudos por aqui, veja também um pouco mais sobre solubilidade para complementar seu conhecimento.
Referências
Atkins, P.W., Jones, L. Princípios de química: questionando a vida moderna e o meio ambiente. 5ª ed., Porto Alegre: Ed. Bookman, 2012.

Por Lucas Makoto Tanaka dos Santos
Bacharel em Química pela Universidade Estadual de Maringá (UEM), mestrando em Química Analítica, com ênfase em desenvolvimento de métodos analíticos, metabolômica e espectrometria de massas no Laboratório de Biomoléculas e Espectrometria de Massas (LaBioMass), na mesma universidade.
Tanaka dos Santos, Lucas Makoto. Densidade. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/densidade. Acesso em: 09 de April de 2025.
1.
Na tabela abaixo temos as densidades de alguns materiais sólidos. Se eles forem adicionados à água líquida e pura, à temperatura ambiente, qual deles flutuará?
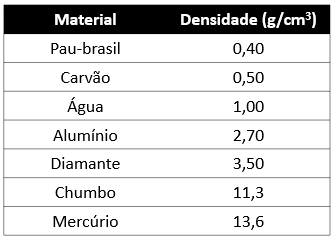
Flutuam os materiais que possuírem a densidade menor que 1,0 g/cm3, que é a densidade da água. Portanto, somente o pau-brasil e o carvão.
2. [FUVEST-SP]
Em uma indústria, um operário misturou, inadvertidamente, polietileno (PE), policloreto de vinila (PVC) e poliestireno (PS), limpos e moídos. Para recuperar cada um destes polímeros, utilizou o seguinte método de separação: jogou a mistura em um tanque contendo água (densidade = 1,00 g/mL), separando, então, a fração que flutuou (fração A) daquela que foi ao fundo (fração B). Depois, recolheu a fração B, secou-a e jogou-a em outro tanque contendo solução salina (densidade = 1,10g/mL), separando o material que flutuou (fração C) daquele que afundou (fração D).
(Dados: densidade na temperatura de trabalho em g/mL: polietileno = 0,91 a 0,98; poliestireno = 1,04 a 1,06; policloreto de vinila = 1,5 a 1,42)
As frações A, C e D eram, respectivamente:
a) PE, PS e PVC
b) PS, PE e PVC
c) PVC, PS e PE
d) PS, PVC e PE
e) PE, PVC e PS
Alternativa “a”
A fração A, que flutuou na água (d = 1,00 g/mL), foi o polietileno (densidade entre 0,91 e 0,98), os outros dois polímeros afundaram. A fração C, que flutuou na solução salina (d = 1,10 g/mL), foi o poliestireno (densidade entre 1,04 e 1,06). A fração D, portanto, é o policloreto de vinila, cuja densidade é maior que a da solução salina, ou seja, entre 1,5 g/mL e 1,42 g/mL, ficando ao fundo da solução.
3. [FMU-SP]
Um vidro contém 200 mL de mercúrio de densidade 13,6 g/mL. A massa de mercúrio contido no vidro é:
a) 0,8 kg
b) 0,68 kg
c) 2,72 kg
d) 27,2 kg
e) 6,8 kg
Dada a equação da densidade:
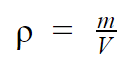
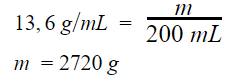
Ou seja, a massa de mercúrio no vidro é de 2,72 kg, alternativa C