A química é uma ciência que investiga a transformação dos elementos, estas que se dão principalmente por meio de reações nas quais pode haver uma mistura de dois ou mais componentes que se transformam em um, dois ou mais produtos. Além de estudar o produto final e o processo de reação, é importante para a química como ciência estudar a velocidade com que a transformação acontece.
Publicidade
Nosso mundo é cercado de reações químicas, podemos citar o amadurecimento de um fruto, o envelhecimento dos seres vivos, a fabricação de uma massa para construção civil, a digestão e o apodrecimento dos alimentos, dentre outros. Olhando para este aspecto, é possível fazer a seguinte pergunta: o que influencia no enferrujamento de um prego? O que controla a velocidade da queima de combustível de um carro?
“Cinética química é a área que investiga a velocidade das reações, efeito de variáveis sobre a taxa de formação de produtos, rearranjo dos átomos e formação de intermediários.” (Atkins, P. W., Jones, L., 2006)
As velocidades de uma reação química são afetadas por fatores como concentração dos reagentes, temperatura de reação, presença de um catalisador e superfície de contato.
1. Velocidade das reações
A velocidade de um evento é definida como a modificação que ocorre em um determinado intervalo de tempo. Sempre que se fala em velocidade está-se empregado a variável tempo. Imaginemos uma reação química hipotética do elemento A se transformando em B, representado pela equação A→B. Supondo que a reação se inicie com 1,0 mol de A, damos início ao monitoramento da reação. Passados 30 minutos, temos 0,46 mol de A e 0,54 mol de B num vaso reacional. Depois de 50 minutos, temos 0,30 mol de A e 0,70 mol de B. Nota-se que tanto em tempo de 30 minutos quanto em 50 minutos, a soma de mol da substância A e de B permanece a mesma: 1,0 mol. A velocidade da reação acaba sendo a medida da rapidez do consumo de A com a produção de B dentro de um certo intervalo de tempo. Logo, podemos traduzir a velocidade média da reação por:
![]()
Onde a letra grega delta, simbolizada por Δ, significa a variação da grandeza de interesse, assim, temos:
Publicidade
Δt = (instante final) – (instante inicial)
Δ mols de B = (mols de B no instante final) – (mols de B no instante inicial)
Notamos também que a velocidade é dada em número positivo, pois indica a formação do produto B. Podemos também dar a velocidade em termos de consumo do reagente A, que pode ser representada por:
Publicidade
![]()
A maior parte das reações químicas tem sua velocidade determinada pelo acompanhamento de variação das concentrações dos reagentes ou dos produtos, sendo assim a unidade de velocidade dada como molaridade por segundo (M/s). Como exemplo, tomemos a reação da água, H2O, com cloreto de butila, C4H9Cl, que reagindo formam o álcool butílico, C4H9OH e ácido clorídrico, HCl:
C4H9Cl(aq) + H2O(l)→C4H9OH(aq) + HCl(aq)
Supondo que se prepare uma solução de concentração igual a 0,1000 M de C4H9Cl em água e se meça a concentração dessa substância em tempos sucessivos, podemos usar estes dados para calcular a velocidade média do desaparecimento de C4H9Cl:
![]()
Em dada reação química, ao se medir a velocidade média deve se levar em conta os coeficientes estequiométricos da equação química equilibrada. Supondo uma reação geral dada por:
aA + bB→cC + dD
A velocidade média da reação é dada por:
![]()
Nota-se que para os reagentes A e B temos um coeficiente negativo porque há o consumo destas substâncias, enquanto em C e D há um coeficiente positivo devido à formação destes no meio reacional.
2. Relação entre velocidade e concentração molar
A Lei de Velocidade foi proposta pelos químicos Peter Waage e Cato Guldberg em 1867, enunciada da forma: “A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, para cada temperatura, elevada a expoentes experimentalmente determinados.”
Para uma reação hipotética, temos sua equação química e sua lei de velocidade escritas como:
aA + bB→cC + dD
V = k[A]x[B]z
Onde V é a velocidade de reação; k é a constante de velocidade, [A] e [B] é a concentração molar das substâncias A e B; e X e Z são os expoentes determinados experimentalmente. Os expoentes X e Z são chamados de ordens de reação, a soma dos expoentes dá a ordem global de reação. Alguns outros exemplos de leis de velocidade são:
2N2O5(g)→4NO2(g) + O2(g)
V = k[N2O5]
CHCl3(g) + Cl2(g)→CCl4(g) + HCl(g)
V = k[CHCl3][Cl2]½
H2(g) + I2(g)→2HI(g)
V = k[H2][I2]
Como a ordem da reação só pode ser determinada experimentalmente, demos alguns exemplos de reações com suas leis de velocidade. Ao se determinar a ordem global, se conta a soma dos expoentes das equações de leis de velocidade.
A primeira reação tem a lei de velocidade dada por V = k[N2O5], seu expoente é igual a 1, portanto é uma reação de primeira ordem.
A segunda reação tem a lei de velocidade dada por V = k[CHCl3][Cl2]½, seus expoentes são ½ e 1, somando ambos temos uma reação de ordem 3/2.
A terceira reação tem a lei de velocidade dada por V = k[H2][I2], onde temos dois expoentes igual a 1, portanto somando ambos temos 2, logo, a reação é de segunda ordem.
A ordem de reação dá subsídios para previsão de como a velocidade da reação é alterada quando se altera a concentração dos reagentes. Tomando como exemplo a terceira reação, já sabemos que é uma reação de segunda ordem, quando se duplica a concentração dos reagentes H2 e I2 a reação quadruplica sua velocidade. Logo, a relação existente entre a velocidade da reação e a concentração dos reagentes é devido ao aumento de moléculas de reagentes que se colidem para formar os produtos, quanto maior a concentração, mais colisões haverá no meio reacional, e mais rápida é a formação dos produtos.
3. Temperatura e velocidade das reações
As velocidades das reações químicas são diretamente afetadas pela temperatura. Podemos observar isso quando se faz um pão: o ingrediente significativo para a massa do pão é o fermento, ao adicionar o fermento à massa, deve deixá-la descansar por certo período de tempo para a massa crescer, sabemos que o crescimento é mais efetivo em temperatura ambiente que em dias de frio. Outro exemplo são as plantas: florestas tropicais com grande variedade de plantas são mais comuns nos trópicos, em latitudes quentes, pois em latitudes mais frias é comum encontrarmos florestas como a tundra, um tipo de vegetação rasteira, sem muitas árvores, logo, as plantas se desenvolvem com mais rapidez em climas mais quentes.
A temperatura de um ambiente onde acontece a reação não afeta diretamente as concentrações, logo, a velocidade sofre aumento com o aumento da temperatura em nível molecular.
Para explicar o efeito da temperatura sobre as moléculas há o modelo das colisões, que tem como ideia principal de que as moléculas têm que colidir para que haja reação. Quanto maior for o número de colisões, maior a velocidade da reação. Pela teoria cinética dos gases, há o corolário de que a elevação da temperatura aumenta o número de colisões, aumentando assim a velocidade das moléculas. Tendo as moléculas velocidades mais elevadas, haverá colisões mais frequentes e com mais energia, o que aumenta a velocidade da reação.
Pelo modelo teórico proposto, nem todas as moléculas colidem-se efetivamente, apenas uma parte das colisões resultam em reações químicas. Para explicar este dilema, o químico sueco Svante Arrhenius sugeriu que as moléculas devem ter uma energia mínima para que pudessem reagir, energia esta denominada por energia de ativação, que pode ser mais bem entendido através da figura abaixo:
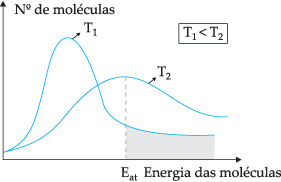
Através do diagrama apresentado, temos a distribuição das energias cinéticas em função do número de moléculas em duas temperaturas diferentes. T1 é mais baixa que T2. Como a energia molecular se transfere por meio de colisões, em T2 por apresentar maior temperatura haverá mais transferência de energia, pois sua energia de ativação há um número maior de moléculas que atingem energia mínima (energia de ativação) para que aconteça a reação. Podemos fazer uma analogia: energia de ativação é a energia mínima para ativar a reação, portanto, quanto maior o número de moléculas em uma energia de ativação alta, mais rápida é a velocidade da reação.
4. Catalisadores
Um catalisador altera a velocidade da reação química sem sofrer modificação em sua estrutura. Os catalisadores são muito comuns na indústria química e biotecnológica, em nosso organismo, na atmosfera, em veículos dentre outros. Podemos citar como exemplo as enzimas, que catalisam reações específicas no corpo, como a pepsina, que é uma enzima digestiva que tem como função desdobrar as proteínas.
A presença de um catalisador numa reação química diminui a energia de ativação, tendo como consequência o aumento da velocidade. A catálise pode ser classificada de acordo com a fase do catalisador:
Catálise heterogênea
Um catalisador heterogêneo está em fase diferente da fase das moléculas de reagente. Geralmente é um sólido em contato com moléculas na fase líquida ou gasosa, muitas reações que passam na indústria se usa um catalisador sólido. Um exemplo é a da manteiga, onde é acrescentado átomos de hidrogênio junto ao óleo que passa a ser gordura. É usado um catalisador de platina, onde os átomos do metal apenas auxiliam na reorganização de átomos de hidrogênio junto às moléculas do ácido graxo correspondente. A etapa inicial da catálise é a adsorção dos reagentes, um processo em que as moléculas aderem à superfície do sólido metálico e colidem com outras moléculas, resultando assim no produto desejado.
Catálise homogênea
O catalisador que está na mesma fase das moléculas dos reagentes é chamado de catalisador homogêneo. Muito usados em fases líquidas e gasosas. Podemos ilustrar como exemplo a decomposição do peróxido de hidrogênio aquoso, H2O2, em água e oxigênio:
2H2O2(aq)→2H2O(l) + O2(g)
Na ausência de catalisador, a reação avança, mas em velocidade muito pequena. O efeito da adição de brometo aquoso, Br–(aq) aumenta a velocidade da reação:
2Br–(aq) + H2O2(aq) + 2H+(aq)→Br2(aq) + 2H2O(l)
O brometo participa da reação e se regenera ao final sendo, portanto, um catalisador por não sofrer mudança química em sua estrutura:
Br2(aq) + H2O2(aq)→2Br–(aq)+ 2H+(aq) + O2(g)
Enzimas
As enzimas são catalisadores presentes nos seres vivos, na qual mantém um grande número de reações que são cuidadosamente controladas. As enzimas são macromoléculas constituídas por proteínas, possuem a característica de seletividade para a catálise, ou seja, catalisam reações específicas operando com somente uma certa substância numa certa reação.
A reação é processada num sítio ativo da enzima, que recebe a molécula específica num modelo semelhante a uma chave e uma fechadura. A substância se ajusta ao sítio ativo enzimático formando um complexo chamado enzima-substrato. Ao se ajustar, a molécula pode sofrer deformações e ficar mais reativa, ocorrendo assim a reação desejada. Após a reação, o produto formado deixa a enzima dando lugar a uma nova reação no sítio ativo.
5. Superfície de contato
A superfície de contato é um dos fatores que influenciam a velocidade de uma reação. Sabemos que uma reação química só ocorre quando há o choque molecular entre dois reagentes. Podemos ilustrar o efeito da superfície de contato imaginando o efeito de um sal de frutas colocado em água. Quando colocamos uma pastilha inteira de sal de frutas em um copo cheio de água, podemos observar a formação de gás carbônico, CO2, através do aborbulhamento. Se dividirmos o mesmo comprimido em partes pequenas e colocar em água, também observaremos o mesmo efeito de aborbulhamento. Se contarmos o tempo que leva para consumir totalmente ambos os comprimidos, veremos que quando macerado o tempo de consumo do sólido será menor.
Este fator se evidencia devido à maior superfície de contato entre o sólido sal de fruta, pois quando macerado em pequenos pedaços, há maior contato com moléculas de água e, consequentemente, mais colisões efetivas, tornando assim a reação de produção de gás carbônico muito mais rápida, ocasionando o desaparecimento total do sólido em menor tempo. Logo, quanto maior a superfície de contato do sólido num meio de reação, mas rápida será a velocidade da reação química.
Referências
ATKINS, P. W., JONES, L., Princípios de química: questionando a vida moderna e o meio ambiente. 3ed. Porto Alegre: Bookman, 2006.
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Cinética química. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/cinetica-quimica. Acesso em: 03 de April de 2025.
1. [ENEM/2010] Alguns fatores podem alterar a rapidez das reações químicas. A seguir destacam-se três exemplos no contexto da preparação e da conservação de alimentos:
I – A maioria dos produtos alimentícios se conserva por muito mais tempo quando submetidos à refrigeração. Esse procedimento diminui a rapidez das reações que contribuem para a degradação de certos alimentos.
II – Um procedimento muito comum utilizado em práticas de culinária é o corte dos alimentos para acelerar o seu cozimento, caso não se tenha uma panela de pressão.
III – Na preparação de iogurtes, adicionam-se ao leite bactérias produtoras de enzimas que aceleram as reações envolvendo açúcares e proteínas lácteas.
Com base no texto, quais são os fatores que influenciam a rapidez das transformações químicas relacionadas aos exemplos I, II e III respectivamente?
a) Temperatura, superfície de contato e concentração.
b) Concentração, superfície de contato e catalisadores.
c) Temperatura, superfície de contato e catalisadores.
d) Superfície de contato, temperatura e concentração.
e) Temperatura, concentração e catalisadores.
2. [UFPR/2012] Segundo a teoria cinética, um gás é constituído por moléculas que se movimentam desordenadamente no espaço do reservatório onde o gás está armazenado. As colisões das moléculas entre si e com as paredes do reservatório são perfeitamente elásticas. Entre duas colisões sucessivas, as moléculas descrevem um MRU. A energia cinética de translação das moléculas é diretamente proporcional à temperatura do gás. Com base nessas informações, considere as seguintes afirmativas:
I) As moléculas se deslocam todas em trajetórias paralelas entre si.
II) Ao colidir com as paredes do reservatório, a energia cinética das moléculas é conservada.
III) A velocidade de deslocamento das moléculas aumenta se a temperatura do gás for aumentada.
a) Somente a afirmativa I é verdadeira.
b) Somente a afirmativa II é verdadeira.
c) Somente a afirmativa III é verdadeira.
d) Somente as afirmativas I e II são verdadeiras.
e) Somente as afirmativas II e III são verdadeiras.
1. [C]
Uma questão que cobra os fatores que influenciam a velocidade de uma reação química. Em ordem temos que o número I nos diz a respeito da temperatura, na qual um alimento fora da geladeira estraga mais rápido, por isso armazena-se num local refrigerado; em II há o aumento da superfície de contato, aumentando-a temos um cozimento mais rápido dos alimentos; em III temos o efeito das bactérias como catalisadoras das reações químicas, aumentando a velocidade de reação entre açucares e proteínas lácteas.
2. [E]
A questão praticamente nos dá a resposta correta. Vamos analisar seu enunciado:
“Segundo a teoria cinética, um gás é constituído por moléculas que se movimentam desordenadamente no espaço do reservatório onde o gás está armazenado” – vemos que esta afirmação descarta a afirmativa I, pois as moléculas de gases estão em movimento caótico, logo seria impossível estarem em movimento ordenado e perfeitamente paralelas entre si.
“As colisões das moléculas entre si e com as paredes do reservatório são perfeitamente elásticas” – pela lei de conservação do movimento aprendida em física, colisões elásticas conservam a energia, logo a afirmativa II está correta, pois quando uma molécula colide com as paredes de um recipiente, as paredes recebem a energia da colisão, ocasionando assim o que chamamos de pressão interna.
“A energia cinética de translação das moléculas é diretamente proporcional à temperatura do gás” – novamente usando os princípios da física podemos juntar com o que estudamos neste artigo: a energia de ativação das moléculas aumenta com a temperatura, logo a afirmativa III está correta.