As reações químicas estão presentes em nosso cotidiano em grande quantidade de exemplos: digestão de alimentos, pintura do cabelo, limpeza de roupas e louça, cozimento de alimentos, dentre outras. Reações químicas precisam de certa quantidade energia para que aconteça, energia que pode vir do aquecimento, luz, e agitação, por exemplo.
Publicidade
Quando há transformação de reagentes para produtos, as reações transcorrem em sua velocidade natural, que geralmente é medida por métodos experimentais no laboratório. No entanto, é preciso aumentar a velocidade de determinada reação, pois seu processo natural é muito lento, sendo assim conveniente o uso de catalisadores.
“Os catalisadores são extremamente importantes para a indústria química, onde seu uso pode aumentar a eficiência de um processo químico ou fazer diminuir o custo total do fabricante.” (Angelucci, C., Godoi G., 2010)
A adição de um catalisador numa reação em curso tem como objetivo acelerar a velocidade das reações, como também alcançar o estado de equilíbrio químico em menor tempo. Do ponto de vista energético, o catalisador diminui a barreira de energia de ativação, possibilitando uma maior rapidez na formação dos produtos.
Os catalisadores não são consumidos durante o curso da reação. Em alguns casos, substâncias que agem como catalisadores são modificadas e depois regeneradas, participando de algum modo da reação, mas nunca consumidas e transformadas em produtos.
1. Catálise homogênea
A catálise homogênea é definida por ter os reagentes e o catalisador na mesma fase (líquido ou gasoso, principalmente). Para ilustrar melhor, usaremos a reação de decomposição do peróxido de hidrogênio, H2O2, catalisado pelo íon brometo:
2H2O2(aq)→H2O(l) + O2(g)
Publicidade
Acima temos a reação global, na qual o peróxido de hidrogênio é decomposto em água e gás oxigênio.
Por meio de estudos experimentais dessa reação, chegou-se à seguinte proposta de mecanismo da reação em etapas:
Etapa 1: 2H2O2(aq) + H3O+(aq)→H2O(l) + H3O2+(aq)
Etapa 2: H3O2+(aq) + Br–(aq)→H2O(l) + HOBr(aq)
Publicidade
Etapa 3: HOBr(aq) + 2H2O2(aq)→+ H3O+(aq) + O2(g) + Br–(aq)
Pelas reações acima, notamos que:
- A substância peróxido de hidrogênio, H2O2, é decomposta na etapa 1;
- O catalisador íon brometo, Br–, aparece na Etapa 2, em seguida é transformado em HOBr e, na Etapa 3 a substância HOBr é decomposta e o íon brometo volta a aparecer;
- Tanto o íon brometo quanto o peróxido de hidrogênio estão em fase aquosa, representado por (aq).
Podemos concluir que a reação dada acima é uma catálise do tipo homogênea, pois reagentes e catalisadores estão numa mesma fase. Nota-se que o íon brometo reage com H3O2+(aq) na Etapa 2 e se regenera na Etapa 3, satisfazendo assim a condição de um catalisador que não é transformado em produto de reação.
2. Catálise heterogênea
A catálise heterogênea é amplamente utilizada na indústria como na fabricação de manteiga, craqueamento de petróleo, produção de amônia, dentre outras.
Um catalisador heterogêneo está em fase diferente dos reagentes. Geralmente para este tipo de processo, o catalisador se apresenta na fase sólida enquanto os reagentes são líquidos ou gasosos. Tomando como exemplo um catalisador sólido, a efetividade da catálise é dependente da capacidade de adsorção, isto é, capacidade das moléculas “grudarem” na superfície do sólido catalisador. Todos os sólidos catalisadores têm essa propriedade de fixação, que acontece pela quantidade de sítios ativos presentes no sólido, onde a molécula do reagente possuindo afinidade por esses sítios se aproxima o suficiente para que aconteça um rearranjo eletrônico com posterior reação química.
Reações químicas com catálise heterogênea são representadas como no exemplo abaixo:
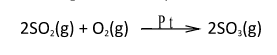
Observamos que os reagentes estão na fase gasosa e o produto também é um gás, logo temos a combinação dos átomos resultando numa reação de adição. Em cima da seta temos o símbolo Pt, referente ao metal Platina. Tal reação nos indica que houve a combinação de dióxido de enxofre com oxigênio numa superfície de platina, metal que agiu como catalisador, formando assim o trióxido de enxofre. A reação é uma catálise heterogênea porque o catalisador é um sólido, enquanto os reagentes são gasosos.
3. Catálise enzimática
A catálise enzimática é processada pelas enzimas, catalisadores biológicos que apresentam atividade em seres vivos.
Enzimas são macromoléculas formadas por proteínas enoveladas que possuem um sítio ativo responsável pela ligação com a molécula de interesse na catálise, esta que recebe o nome de substrato. São altamente seletivas, não catalisam qualquer substrato, para cada enzima há um substrato específico responsável pelo aumento da velocidade de reação.
O mecanismo geral para as reações enzimáticas é dado no exemplo abaixo:
Etapa 1: E + S↔ES
Etapa 2: ES→Produtos + E
Por meio das reações acima, temos que:
- A Etapa 1 é onde ocorre a associação da enzima, E, com o substrato, S, formando um complexo denominado enzima-substrato, ES.
- Na Etapa 2, o complexo enzima-substrato é dissociado espontaneamente formando o produto desejado e a enzima retorna a seu estado inicial.
Normalmente, o mecanismo de catálise enzimática é associado ao esquema chave-fechadura devido à seletividade da enzima, onde o substrato é “encaixado” junto ao sítio ativo para a formação do produto.
4. Gráfico de energia de reação com catalisador
Numa reação que envolve a presença do catalisador há o aumento da velocidade de reação apenas. Para que a reação ocorra, a energia de ativação é diminuída, ou seja, a barreira energética é menor, possibilitando assim a formação do produto. Convém lembrar que o uso de catalisadores não altera a ordem da reação. O gráfico do perfil energético de reações com ou sem a presença de catalisadores é dado abaixo:

Pelo gráfico acima, observa-se que uma reação com catalisador possui menor energia de ativação quando não há catalisador. Percebe-se também que o valor de energia total da reação (entalpia), ΔH, também não é alterado. Este princípio energético é válido para reações com catálise homogênea, heterogênea e enzimática.
Referências
ANGELUCCI, G., Godoi, G., Cinética Química. São Cristóvão: Universidade Federal de Sergipe, CESAD, 2009.

Por Douglas Benício
Graduado em Química - Licenciatura (UEM)
Benício, Douglas. Catálise. Todo Estudo. Disponível em: https://www.todoestudo.com.br/quimica/catalise. Acesso em: 26 de April de 2025.
1. [USP/FUVEST/2013] Quando certos metais são colocados em contato com soluções ácidas, pode haver formação de gás hidrogênio. Abaixo, segue uma tabela elaborada por uma estudante de Química, contendo resultados de experimentos que ela realizou em diferentes condições.
Após realizar esses experimentos, a estudante fez três afirmações:
I. A velocidade da reação de Zn com ácido aumenta na presença de Cu.
II. O aumento na concentração inicial do ácido causa o aumento da velocidade de liberação do gás H2.
III. Os resultados dos experimentos 1 e 3 mostram que, quanto maior o quociente superfície de contato/massa total de amostra de Zn, maior a velocidade de reação.
Com os dados contidos na tabela, a estudante somente poderia concluir o que se afirma em:
a) I
b) II
c) I e II
d) I e III
e) II e III
2. [UFRN/2010] O desenvolvimento sustentável pode ser considerado como a busca por alternativas ara melhorar as condições de vida sem que se degrade o meio ambiente. A química pode colaborar nessa busca, controlando as reações das substâncias lançadas no ambiente.
Um exemplo típico dessa colaboração é o uso, nos conversores catalíticos dos automóveis, de catalisadores, cuja função, nessa situação, é aumentar a velocidade da reação de poluentes produzidos pela combustão, transformando-os em substâncias menos poluentes, uma vez que:
a) A energia de ativação do complexo ativado, na etapa lenta do mecanismo da reação, diminui.
b) A energia de ativação do complexo ativado, na etapa lenta do mecanismo da reação, aumenta.
c) A freqüência dos choques entre as partículas aumenta, sem que a energia de ativação varie.
d) A freqüência dos choques entre as partículas diminui, sem que a energia de ativação varie.
1. [D]
Analisando a tabela, temos as seguintes condições: a concentração de ácido clorídrico é a mesma para todos os experimentos, assim como seu volume; no experimento 4 há zinco e cobre; no experimento 2 tem apenas cobre e não houve nenhuma alteração no meio reacional; no experimento 1 tem zinco em raspas e no experimento 3 tem zinco em pó e houve tempos diferentes entre ambos os experimentos para a liberação de hidrogênio.
De posse desses dados importantes, observamos que a afirmativa I está correta, pois no experimento 1 tem zinco em raspas e demorou 30 segundos para liberação de gás, no experimento 2 há zinco na forma de pó e demorou 18 segundos para se observar o hidrogênio, enquanto no experimento 4 há zinco e cobre demorando apenas 8 segundos para o aparecimento de gás. Logo, o cobre agiu como catalisador da reação.
A afirmativa II não está correta porque não há variação da concentração de ácido clorídrico.
A afirmativa III está correta, pois nos experimentos 1 e 3 tem zinco na mesma porção de massa (1,0g), mas em 3 o metal está na forma de pó, ou seja, há uma maior superfície de contato do zinco com a solução de ácido clorídrico, por isso o tempo em relação ao experimento que contém zinco em raspas foi menor para a liberação de gás hidrogênio.
2. [A]
Um catalisador tem a função de aumentar a velocidade de uma reação diminuindo a energia de ativação sem alterar a entalpia. Analisando o gráfico da Figura 1 no texto vemos claramente esse fenômeno energético. A frequência dos choques entre as moléculas tem a ver com a temperatura, não com catalisador, pois a temperatura é um fator que influencia a velocidade de reação sem alterar a energia de ativação.